新情境命题2 聚焦科技前沿 专项练增分提能(含解析)2024年高考化学二轮复习
2024-04-14 18:35:55 学考宝 作者:佚名
Word文档版
学考宝(xuekaobao.com)友情提示:html格式不完整,如有需要请根据文末提示下载并进行二次校对Word文档。
新情境命题2 聚焦科技前沿
1.(2023·茂名统考)我国在一些关键核心技术实现了突破,载人航天、探月探火、深海深地探测、超级计算机、卫星导航等领域取得重大成果。下列成果中所用材料属于合金的是( )
A.天问一号用的SiO2气凝胶 B.天和核心舱用的BN陶瓷 C.“奋斗者”号潜水艇的钛铝外壳 D.北斗导航卫星的太阳能电池用的氮化镓
2.(2023·清远一中模拟)“科技自立自强”、“着力造就拔尖创新人才”是党的二十大对科技发展的要求与期待。先进的材料科学助力现代科技的高速发展。下列说法正确的是( )
A.我国自主研发的JD-1紫外光固化树脂属于新型无机非金属材料
B.我国“神舟十二号”飞船返回舱的舱体外壳部件材料是由金属复合材料——专业的铝合金材料制成的,主要是利用了其硬度大的特性
C.宇航服一般由14层不同的材料组成,常用的材料有聚酯膜、聚四氟乙烯等,聚四氟乙烯与溴水可以发生加成反应
D.光刻机是生成计算机芯片的机器,芯片制作过程中用到的光刻胶是由马来酸酐()等共聚而成,马来酸酐的分子式为C4H2O3
3.(2023·梅州统考)我国科学家在月壤粉末的部分铁橄榄石颗粒表面非晶层中发现了单质铁,产生的原因为:铁橄榄石被撞击时在高温与高压下发生熔融,同时其中的Fe2+发生歧化反应生成Fe与Fe3+。下列说法正确的是( )
A.Fe2+在生成Fe3+时失去电子,发生还原反应
B.可用X射线衍射实验测定铁橄榄石的晶体结构
C.Fe2+和Fe含有的电子数相同
D.基态Fe3+的核外电子有26种不同的运动状态
4.2022年诺贝尔化学奖颁发给为点击化学发展做出贡献的3位科学家。点击反应的原料之一——化合物M(结构如图),下列说法正确的是( )
A.属于烃,能使酸性高锰酸钾溶液褪色
B.分子中所有碳原子共平面
C.分子中没有手性碳原子
D.1 mol该物质与H2反应,最多可消耗5 mol H2
5.我国科学家利用M制备的有机—金属框架(MO)可以高效快速分离CO2和N2,M的结构式如图所示。短周期主族元素Y、Z、R、X的原子半径依次减小,四种元素的原子序数均不超过10。下列说法正确的是( )
A.最简单氢化物的沸点:R >Z>Y
B.R的单质与X2Z不发生反应
C.简单离子半径:Z >R
D.YX3YX2ZX不溶于水
6.我国科学家在苯炔不对称芳基化反应方面取得重要进展,一定条件下该反应转化如下:
下列说法正确的是( )
A.箭头a所示C—H比箭头b所示C—H活泼
B.1 mol苯炔中所含σ键的数目为10NA
C.1 mol有机物Y最多可与3 mol H2发生加成反应
D.有机物Y可能易溶于水
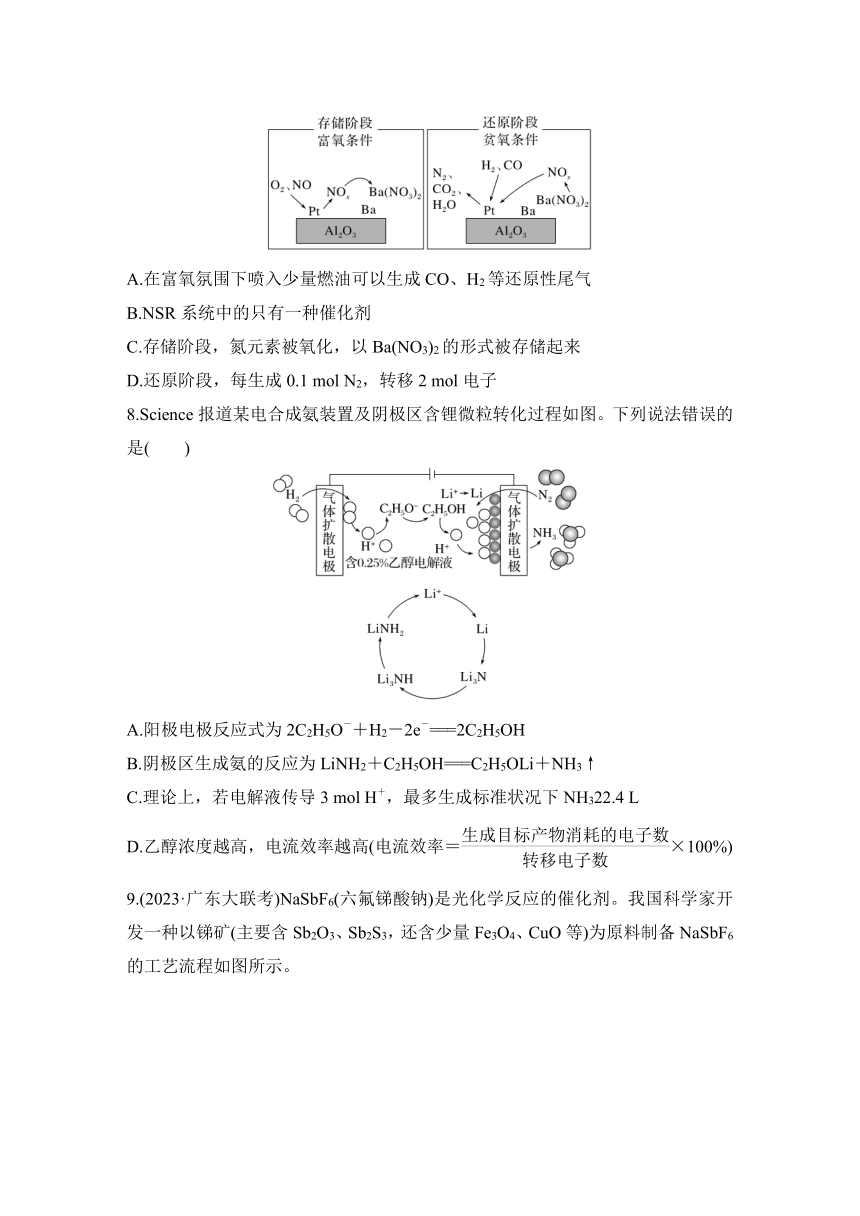
7.(2023·广东六校三次联考)目前,汽车尾气系统中均安装了催化转化器,这种方法是处理NOx的“储存还原技术法”,简称NSR,工作原理如图所示。下列说法中正确的是( )
A.在富氧氛围下喷入少量燃油可以生成CO、H2等还原性尾气
B.NSR系统中的只有一种催化剂
C.存储阶段,氮元素被氧化,以Ba(NO3)2的形式被存储起来
D.还原阶段,每生成0.1 mol N2,转移2 mol电子
8.Science报道某电合成氨装置及阴极区含锂微粒转化过程如图。下列说法错误的是( )
A.阳极电极反应式为2C2H5O-+H2-2e-===2C2H5OH
B.阴极区生成氨的反应为LiNH2+C2H5OH===C2H5OLi+NH3↑
C.理论上,若电解液传导3 mol H+,最多生成标准状况下NH322.4 L
D.乙醇浓度越高,电流效率越高(电流效率=×100%)
9.(2023·广东大联考)NaSbF6(六氟锑酸钠)是光化学反应的催化剂。我国科学家开发一种以锑矿(主要含Sb2O3、Sb2S3,还含少量Fe3O4、CuO等)为原料制备NaSbF6的工艺流程如图所示。
已知:①Sb2O3的化学性质类似于Al2O3,Sb2S3溶于NaOH浓溶液;
②NaSbO3·3H2O难溶于水,NaSbF6易溶于水;
③常温下,Ksp(CuS)=6.0×10-36。
回答下列问题:
(1)NaSbF6的组成元素中第一电离能最大的是________(填元素符号)。
(2)“碱浸”前,先将锑矿粉碎过筛的目的是____________________________
__________________________________________________________________。
(3)“除杂”时生成CuS的化学方程式为________________________________
__________________________________________________________________,
“除杂”结束后溶液中c(S2-)=1×10-6 mol·L-1,此时溶液中c(Cu2+)=________ mol·L-1。
(4)“转化”中H2O2与NaSbO2溶液发生反应,该反应中氧化剂与还原剂的物质的量之比为________;分离出NaSbO3·3H2O的操作是________(填名称);“转化”时适当加热可提高反应速率,但是温度过高,转化效率降低,其主要原因是_________________________________________________________________
_________________________________________________________________。
(5)“氟化”中加入氢氟酸,“氟化”不能使用陶瓷容器,其主要原因是___________________________________________________________________
___________________________________________________________________。
10.2022年11月30日,神舟十五号与神舟十四号乘组在“太空会师”。太空生命保障系统利用电解水供氧,生成的氢气与宇航员呼出的二氧化碳在催化剂作用下生成水和甲烷,水可循环使用。
(1)已知CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-890 kJ· mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-572 kJ· mol-1
H2O(l)===H2O(g) ΔH=+44 kJ· mol-1
写出H2(g)与CO2(g)反应生成CH4(g)和H2O(g)的热化学方程式________________。
(2)一定条件下,反应CO2(g)+4H2(g)CH4(g)+2H2O(g)达到平衡状态。
①下列操作中,能提高此平衡转化率的是________。
a.加入催化剂
b.降低反应温度
c.移除H2O(g)
d.恒温恒压下通入惰性气体
②某科研小组在一定温度下模拟该反应,向容积为5L的抽空的密闭容器中通入0.2 mol CO2和0.6 mol H2,反应平衡后测得CO2的转化率为50%,则该反应的平衡常数为________。
(3)在相同条件下,CO2(g)与H2(g)还会发生以下副反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),该副反应的发生不利于氧循环,原因是____________________________________________________________________
__________________________________________________________________。
(4)已知反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),CO2(g)+H2(g)CO(g)+H2O(g)。为了提高甲醇的选择性,某科研团队研制了一种具有反应和分离双功能的分子筛膜催化反应器,原理如图所示。
保持压强为3 MPa,温度为260 ℃,向密闭容器中按投料比=3投入一定量CO2和H2,不同反应模式下CO2的平衡转化率和甲醇的选择性的相关实验数据如下表所示。
实验组 反应模式 温度/℃ CO2的平衡转化率/% CH3OH的选择性/%
Ⅰ 普通催化反应器 3 260 21.9 67.3
Ⅱ 分子筛膜催化反应器 3 260 36.1 100
①双功能的分子筛膜催化反应器模式下,恒温恒容时发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),不能说明反应达到化学平衡状态的是________。
a.c(H2O)的浓度不变
b.混合气体的平均相对分子质量不变
c.混合气密度不变
d.断裂3 mol H—H的同时断裂2 mol O—H
②由表中数据可知,双功能的分子筛膜催化反应器模式下,CO2的转化率明显提高,可能的原因是:_________________________________________________
________________________________________________________________。
新情境命题2 聚焦科技前沿
1.C [A.SiO2属于无机非金属材料,A错误;B.BN陶瓷是新型陶瓷材料,属于无机非金属材料,B错误;C.钛铝外壳属于合金材料,C正确;D.氮化镓是化合物,不是合金材料,D错误。]
2.D [A.我国自主研发的JD-1紫外光固化树脂属于有机高分子材料,故A错误;B.返回舱侧壁金属壳体铝合金及烧蚀涂层均需具备质量轻、强度大、耐高温的特性,故B错误;C.聚四氟乙烯中没有不饱和键,不能与溴水发生加成反应,故C错误;D.光刻机是生成计算机芯片的机器,芯片制作过程中用到的光刻胶是由马来酸酐( )等共聚而成,马来酸酐的分子式为C4H2O3,故D正确。]
3.B [A.Fe2+在生成Fe3+时失去电子,被氧化,发生的是氧化反应,A错误;B.X射线衍射实验可区分晶体和非晶体,可测定铁橄榄石的晶体结构,B正确;C.Fe2+含有的电子数=26-2=24,Fe含有的电子数=质子数=26,两者电子数不相同,C错误;D.基态Fe3+的核外有23个电子,所以有23种不同的运动状态,D错误。]
4.C [A.M中除含有C、H元素外还含有O、Br元素,不属于烃,分子中含有碳碳三键,能使酸性高锰酸钾溶液褪色,选项A错误;B.M中存在-C(CH3)3结构,根据甲烷的正四面体结构,该结构中的碳原子不可能全共平面,选项B错误;C.手性碳原子是指与四个各不相同原子或基团相连的碳原子,分子中不存在手性碳原子,选项C正确;D.分子中含有二个碳碳三键和一个苯环,1 mol该物质与H2反应,最多可消耗7 mol H2,选项D错误。]
5.C [短周期主族元素Y、Z、R、X的原子半径依次减小,四种元素的原子序数均不超过10,通过分析M的结构式可知,Y能形成4个键,即Y为C;Z能形成2个键,即Z为O;R、X均形成1个键,且R、X的原子半径依次减小,说明R为F、X为H。A.H2O和HF能形成分子间氢键,使沸点升高且H2O分子形成的氢键数目较多,因此最简单氢化物沸点的顺序为H2O >HF >CH4,A错误;B.F2能与H2O发生氧化还原反应生成HF和O2,B错误;C.核外电子排布相同,核电荷数越小,半径越大,简单离子半径顺序为:r(O2-) >r(F-),C正确;D.CH3CH2OH能与水以任意比例互溶,D错误。]
6.B [A.由图可知,有机物X中箭头b所示的氢原子和苯炔发生了加成反应,说明箭头b所示C—H比箭头a所示C—H活泼,故A错误;B.苯炔中含有碳碳之间以及碳氢之间形成的9个σ键和碳碳三键中的1个σ键,则1 mol苯炔中所含σ键的数目为10NA,故B正确;C.有机物Y中苯环和羰基可以和H2发生加成反应,1 mol有机物Y最多可与4 mol H2发生加成反应,故C错误;D.有机物Y中含有苯环和酯基这样的疏水基团,不可能易溶于水,故D错误。]
7.C [A.在富氧氛围下,氧气充足,喷入少量燃油可以生成CO2、H2O等,而不是生成还原性尾气,A错误;B.NSR系统中的催化剂有Pt、Ba,不是一种,B错误;C.由图可知,存储阶段,氮元素化合价升高被氧化,以Ba(NO3)2的形式被存储起来,C正确;D.还原阶段氮元素化合价由+5变为0发生还原反应,氢气、一氧化碳均发生氧化反应,电子转移为N2~10e-,每生成0.1 mol N2,转移1 mol电子,D错误。]
8.D [A.阳极发生失电子的氧化反应,由图可知,阳极电极反应式为2C2H5O-+H2-2e-===2C2H5OH,A项正确;B.由图可知,阴极区氮气得电子,并结合锂离子先转化为LiNH2,后与C2H5OH反应生成了氨气,即生成氨的反应为LiNH2+C2H5OH===C2H5OLi+NH3↑,B项正确;C.LiNH2和C2H5OH羟基中的H均来自电解液传导的氢离子,理论上,若电解液传导3 mol H+,根据生成氨的反应LiNH2+C2H5OH===C2H5OLi+NH3↑可知,最多生成1 mol NH3,标准状况下为22.4 L,C项正确;D.由电池总反应:N2+3H2===2NH3可知,乙醇属于中间产物,乙醇浓度增大,电流效率无明显变化,D项错误。]
9.答案 (1)F
(2)增大固体和液体接触面积
(3)Na2S+CuSO4===CuS↓+Na2SO4 6.0×10-30
(4)1∶1 过滤 温度过高,双氧水分解加快,反应物浓度降低
(5)陶瓷的主要成分是硅酸盐,HF能与硅酸盐反应
解析 锑矿粉(主要含Sb2O3、Fe3O4、Sb2S3、CuO等)加NaOH浓溶液、Na2S2O3溶液进行碱浸、还原,过滤除去不溶的Fe3O4、CuO,Sb2O3、Sb2S3直接与碱反应,Sb元素转化为NaSbO2,Sb2S3中的S元素转化为Na2S;含NaSbO2、Na2S的溶液加硫酸铜将硫离子转化为CuS,将过量的氢氧根离子转化为氢氧化铜除去,得到主要溶质为NaSbO2的溶液,NaSbO2溶液加过氧化氢、浓NaOH转化得到NaSbO3·3H2O,再用HF进行氟化得到NaSbF6。(1)非金属性越强,第一电离能越大,NaSbF6的组成元素中第一电离能最大的是F;(2)粉碎可以增大接触面积,加快反应速率,“碱浸”前,先将锑矿粉碎过筛的目的是增大固体和液体的接触面积;(3)“除杂”时Na2S和CuSO4反应生成CuS沉淀,化学方程式为Na2S+CuSO4===CuS↓+Na2SO4,“除杂”结束后溶液中c(S2-)=1×10-6 mol·L-1,此时溶液中c(Cu2+)= mol/L=6.0×10-30 mol/L;(4)由分析可知,向滤液2中加入H2O2和浓NaOH溶液将NaSbO2转化为NaSbO3·3H2O晶体,根据氧化还原反应配平可得“转化”步骤发生反应的化学方程式为NaSbO2+H2O2+2H2O===NaSbO3·3H2O,该反应中氧化剂与还原剂的物质的量之比为1∶1;NaSbO3·3H2O作为晶体析出,分离出NaSbO3·3H2O的操作是过滤;双氧水受热易分解,“转化”时适当加热可提高反应速率,但是温度过高,转化效率降低,其主要原因是温度过高,双氧水分解加快,反应物浓度降低;(5)陶瓷成分为硅酸盐,含二氧化硅,氢氟酸可以和二氧化硅反应,“氟化”不能使用陶瓷容器,其主要原因是陶瓷的主要成分是硅酸盐,HF能与硅酸盐反应。
10.答案 (1)CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH=-166 kJ· mol-1 (2)①bc ②625
(3)副反应中,氢气转化为水的量少,不利于氧循环
(4)①cd ②双功能的分子筛膜催化反应器模式下,只发生第一个反应,双功能的分子筛膜能及时分离出水蒸气,平衡右移,二氧化碳产率增大
解析 (1)①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-890 kJ· mol-1
②2H2(g)+O2(g)===2H2O(l) ΔH2=-572 kJ· mol-1
③H2O(l)===H2O(g) ΔH=+44 kJ· mol-1
则H2(g)与CO2(g)反应生成CH4(g)和H2O(g)的方程式为:④CO2(g)+4H2(g)??CH4(g)+2H2O(g),根据盖斯定律可知,②×2-③×2-①得,该反应的ΔH=-166 kJ· mol-1,其热化学方程式为:CO2(g)+4H2(g)??CH4(g)+2H2O(g) ΔH=-166 kJ· mol-1;(2)①a.加入催化剂只能改变反应速率,平衡不移动,不能改变转化率,a错误;b.该反应为放热反应,降低反应温度平衡正向移动,可以提高平衡转化率,b正确;c.移除H2O(g),则水蒸气的浓度减小,平衡正向移动,转化率增大,c正确;d.恒温恒压下通入惰性气体,容器体积增大,平衡逆向移动,转化率减小,d错误;故选bc;
②根据题给信息可得三段式如下,
,
则平衡常数K==625;
(3)副反应中,氢气转化为水的量少,不利于氧循环;
(4)①a.c(H2O)的浓度不变,说明正逆反应速率相等,反应达到平衡状态,a正确;b.该反应前后气体的计量系数不同,且反应都是气体,则混合气体的平均相对分子质量是一个变量,当其不变的时候可以证明反应达到平衡,b正确;c.容器的体积不变,且反应物和产物都是气体,总质量不变,则混合气密度不是变量,其不变的时候,不能证明反应达到平衡,c错误;d.水中和甲醇中都含有O—H,则断裂3 mol H—H的同时断裂2 mol O—H不能证明正逆反应速率相等,不能证明反应达到平衡,d错误;故选cd;②由表中数据可知双功能的分子筛膜催化反应器模式下,只发生第一个反应,双功能的分子筛膜能及时分离出水蒸气,平衡右移,二氧化碳产率增大。
图片资源预览