甘肃省武威市重点中学2023-2024学年高二上学期期末考试化学试题(含答案)
2024-01-06 18:31:39 学考宝 作者:佚名
Word文档版
学考宝(xuekaobao.com)友情提示:html格式不完整,如有需要请根据文末提示下载并进行二次校对Word文档。
武威七中2023年秋学期高二年级期末考试试卷
化学
满分100分,考试时间75分钟
可能用到的相对原子量: H 1 C 12 N 14 O 16 Fe 56 Cu 64 Co 59 Ag 108
一、单选题(每空3分,共48分.每小题只有一个正确答案)
1.化学与人类生产、生活密切相关,下列有关说法不正确的是
A.新冠病毒可用次氯酸钠溶液或双氧水消毒,其消毒原理相同
B.用K2FeO4代替Cl2处理饮用水时,既有杀菌消毒作用,又有净水作用
C.草木灰和铵态氮肥混合使用肥效更好
D.“自嗨锅”加热食物是利用了化学反应的热效应
2.下列化学用语或图示表达正确的是
A.HClO的电子式:
B.原子核内中子数为20的氯原子:
C.基态磷原子的轨道表示式:
D.基态S原子的核外电子排布式
3.下列离子方程式书写正确的是
A.NaHSO3溶液的水解方程式:+H2OH3O++
B.氯气与水反应方程式:Cl2+H2OH++Cl-+HClO
C.铅酸蓄电池充电时的阳极反应:Pb2++2H2O-2e-=PbO2+4H+
D.向碳酸氢铵稀溶液中加足量稀氢氧化钡溶液:++2OH-=NH3·H2O++H2O
4.N2H4、N2O4常用作火箭发射的推进剂。火箭推进剂发生的反应为:2N2H4(1)+N2O4(1)=3N2(g)+4H2O(g)。下列有关说法正确的是
A.充有N2O4的密闭容器中存在:N2O4(g)2NO2(g),当c(N2O4)=c(NO2)时,该可逆反应到达限度
B.碱性N2H4-空气燃料电池工作时,负极电极反应式为N2H4+4e-+4OH-=N2+4H2O
C.反应每生成0.9molN2,转移电子的数目为2.4×6.02×1023
D.N2H4的水溶液中存在:N2H4+H2O+OH-,向稀溶液中加水稀释,值变大
5.氮的化合物种类繁多,应用广泛,下列不同状态的氮原子其能量最高的是
A. B.
C. D.
6.NA表示阿伏加德罗常数的值,下列说法正确的是
A.0.1mol/L的NH4Cl溶液中浓度小于0.1NA
B.室温下,等体积的pH=1的溶液和pH=1的溶液,所含有的的个数均为0.1NA
C.3.2gCH4中所含σ键数目为0.8NA
D.1mol基态Al原子位于p能级上的电子数为3NA
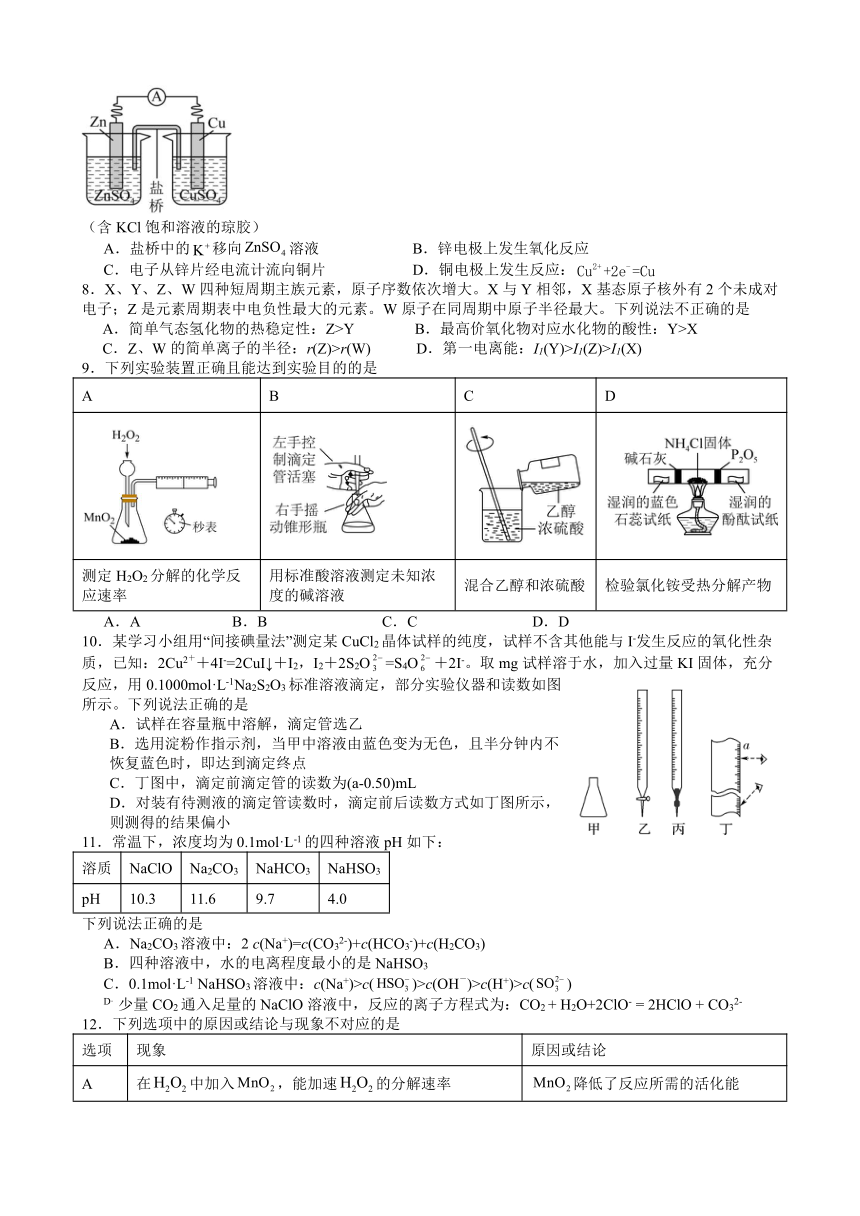
7.锌铜原电池装置如图,下列说法不正确的是
(含KCl饱和溶液的琼胶)
A.盐桥中的移向溶液 B.锌电极上发生氧化反应
C.电子从锌片经电流计流向铜片 D.铜电极上发生反应:
8.X、Y、Z、W四种短周期主族元素,原子序数依次增大。X与Y相邻,X基态原子核外有2个未成对电子;Z是元素周期表中电负性最大的元素。W原子在同周期中原子半径最大。下列说法不正确的是
A.简单气态氢化物的热稳定性:Z>Y B.最高价氧化物对应水化物的酸性:Y>X
C.Z、W的简单离子的半径:r(Z)>r(W) D.第一电离能:I1(Y)>I1(Z)>I1(X)
9.下列实验装置正确且能达到实验目的的是
A B C D
测定H2O2分解的化学反应速率 用标准酸溶液测定未知浓度的碱溶液 混合乙醇和浓硫酸 检验氯化铵受热分解产物
A.A B.B C.C D.D
10.某学习小组用“间接碘量法”测定某CuCl2晶体试样的纯度,试样不含其他能与I-发生反应的氧化性杂质,已知:2Cu2++4I-=2CuI↓+I2,I2+2S2O=S4O+2I-。取mg试样溶于水,加入过量KI固体,充分反应,用0.1000mol·L-1Na2S2O3标准溶液滴定,部分实验仪器和读数如图所示。下列说法正确的是
A.试样在容量瓶中溶解,滴定管选乙
B.选用淀粉作指示剂,当甲中溶液由蓝色变为无色,且半分钟内不恢复蓝色时,即达到滴定终点
C.丁图中,滴定前滴定管的读数为(a-0.50)mL
D.对装有待测液的滴定管读数时,滴定前后读数方式如丁图所示,则测得的结果偏小
11.常温下,浓度均为0.1mol·L-1的四种溶液pH如下:
溶质 NaClO Na2CO3 NaHCO3 NaHSO3
pH 10.3 11.6 9.7 4.0
下列说法正确的是
A.Na2CO3溶液中:2 c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.四种溶液中,水的电离程度最小的是NaHSO3
C.0.1mol·L-1 NaHSO3溶液中:c(Na+)>c()>c(OH-)>c(H+)>c()
少量CO2通入足量的NaClO溶液中,反应的离子方程式为:CO2 + H2O+2ClO- = 2HClO + CO32-
12.下列选项中的原因或结论与现象不对应的是
选项 现象 原因或结论
A 在中加入,能加速的分解速率 降低了反应所需的活化能
B 将盛有气体的密闭容器浸泡在热水中,容器内气体颜色变深 ,平衡向生成方向移动
C 向溶液中加入溶液,溶液呈红色,再滴加几滴溶液,溶液颜色变浅 增大生成物浓度,平衡向逆反应方向移动
D 在密闭容器中有反应:,达到平衡时测得为,将容器容积扩大到原来的2倍,测得为
A.A B.B C.C D.D
13.某温度下,将和体积均相同的和溶液分别加水稀释,其随加水体积的变化如图所示。下列叙述正确的是
A.稀释前溶液的浓度:
B.曲线Ⅱ表示的是HCl稀释的过程
C.从b点到d点,溶液中逐渐增大
D.溶液中水的电离程度:b点 > c点
14.已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。其中A是宇宙中含量最多的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布式为;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是
A.A、B、C三种元素的电负性:B>C>A
B.B、C、D、E四种元素的第一电离能:B>C>E>D
C.B、C形成的化合物为酸性氧化物
D.F的常见离子的核外电子排布图为
15.设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成,将废旧锂离子电池的正极材料转化为,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是
A.装置工作一段时间后,乙室应补充盐酸
B.装置工作时,甲室溶液pH逐渐增大
C.乙室电极反应式为
D.若甲室减少200mg,乙室增加400mg,则此时已进行过溶液转移
16.室温下向10mL0.1mol·L-1NaOH溶液中加入0.1mol·L-1的一元酸HA,测得溶液pH的变化曲线如图所示。下列说法正确的是
A.a点所示溶液中c(Na+)>c(A )>c(HA)>c(OH )
B.pH=7时,c(Na+)=c(A )+c(HA)
C.a点所示溶液中水电离的c(H+)=10-8.7mol/L
D.b点所示溶液中c(A )>c(Na+)
二、填空题(52分)
17.(14分)某电化学原理的示意图如图。填写下列空白:
(1)甲池中通入的电极为 极,通入的电极上发生的电极反应为 ;工作过程中,甲池溶液的碱性会 (填“增强”、“减弱”或“不变”,下同)。若将甲池中的溶液换成稀硫酸,工作过程中,甲池溶液的酸性会 。
(2)若乙池中A为石墨电极,则A作 极,该电极的电极反应式为 ;若乙池中A为铁电极,当铁电极的质量增加时,理论上甲池中消耗的氧气在标准状况下的体积为 L。
(3)若将乙池设计为电解精炼铜的装置,则 (填“A”或“B”,下同)极为粗铜;若将乙池改为电镀装置,则 极为待镀金属制品。
(4)若将乙池中的硝酸银溶液换为硫酸铜溶液,通电一段时间后,向所得溶液中加入碱式碳酸铜后恰好恢复至电解前的状态,则电解过程中转移的电子数目为 。
18.(12分)
(1)已知25℃时,醋酸,0.1mol/L的醋酸溶液的pH= 。
(2)相同物质的量浓度的五种溶液:①(NH4)2SO4 ②氨水③NH4HSO4 ④NH4Cl⑤(NH4)2Fe(SO4)2 ,c(NH4+)由大到小顺序是 (用序号表示)。
(3)可溶性铝盐常用作净水剂的原因: (用离子方程式表示)。
(4)将等体积等物质的量浓度的CH3COONa和NaF溶液混合:c(CH3COOH)+c(HF) c(OH-)-c(H+)
(填 > 或 < 或 =)
(5)某温度下,测得的0.001mol/LHCl溶液中,由水电离出来的。求此温度下,水离子积常数为 。在此温度下,将的HCl溶液和的溶液混合均匀,测得溶液的pH=7,则 。
19.(11分)在恒温下,向容积为2L的恒容容器中加入一定量的碳单质和2molH2O(g),初始压强为105Pa。发生反应: H>0。经过2min后达到平衡,容器的压强增加了20%。
(1)该反应自发进行的条件是 。(填“高温”或“低温”或“任意条件”)
(2)2min内H2O的平均反应速率为 mol/(L·min)。
(3)2min平衡时,采取下列措施后,使的是__________。
A.恒温恒容下,除去部分H2O B.降低温度
C.恒温恒容下,充入Ar D.恒温恒压下,充入Ar
(4)平衡常数Kp= Pa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)下列说法正确的是__________。
A.增加碳单质,可以加快该反应速率 B.2min时,H2O的转化率为20%
C.当混合气体的平均摩尔质量不再变化时,可以判断该反应达到了平衡
D.平衡后向体系内补加0.4molH2O(g)和0.4molCO(g),反应向逆反应方向进行
20.(15分)完成下列问题。
(1)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是
(2)①基态Cu原子有 种不同能级的电子。位于在周期表 区(填s、p、d或ds)。
Cu+的价电子排布式为 .
②N原子中最高能级的电子的电子云轮廓图为 。
③在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是 。
(3)由于Be与Al处于对角线位置,性质具有相似性,根据“对角线规则”,写出Be(OH)2与NaOH反应的化学方程式: 。
(4)高锰酸钾是一种重要的化学试剂,实验室常常利用高锰酸钾溶液测定草酸晶体(H2C2O4·xH2O)中的值,
高锰酸钾溶液需用 盛装(填 酸式滴定管 或 碱式滴定管)
滴定终点溶液的判断是 颜色变化为由无色变为浅红色.
答案
一、单选题(每空3分,共48分.每小题只有一个正确答案)
1 C 2 D 3 B 4 C 5 B 6 C 7 A 8 D 9 B 10 B
11 B 12 C 13 A 14 B 15 A 16 D
二.非选择题(共52分)
17【答案】(14分)
(1) 正(1分) (2分)
减弱(1分) 减弱(1分)
(2) 阴 (1分) (2分) 0.56(2分)
(3) B (1分) A(1分)
(4) 3(2分)
18【答案】(12分)
3(2分)
⑤①③④②(2分)
Al3++3H2O Al(OH)3(胶体)+3H+(2分)
=(2分)
(5) 1×10-12 (2分) 9∶1(2分)
19【答案】(11分)
高温(2分)
0.1(2分)
B(2分)
5000(2分)
BCD(3分)
20【答案】(15分)
(1) (2分)
(2) 7(1分) ds(1分) 3d10 (2分) 哑铃形(2分)
Fe2+价电子排布式为3d6,而Fe3+的价电子排布式为3d5,为半充满稳定结构,故FeO稳定性小于Fe2O3(2分)
(3) Be(OH)2+2NaOH=Na2BeO2+2H2O (2分)
(4) 酸式滴定管(1分)
滴入最后半滴标准液后,溶液颜色变化为由无色变为浅红色且半分钟内不褪色(2分)
图片资源预览