甘肃省白银市部分高中2023-2024学年高三上学期10月阶段检测联考化学试题(含答案)
2023-10-24 12:48:54 学考宝 作者:佚名
Word文档版
学考宝(xuekaobao.com)友情提醒:html格式不完整,如有需要请根据文末提示下载并进行二次校对Word文档。
白银市部分高中2023-2024学年高三上学期10月阶段检测联考
化学
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:高考全部内容。
5.可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活密切相关。下列叙述正确的是( )
A.利用活性炭粉的还原性除去汽车中的异味
B.天然气中添加有特殊气味的乙硫醇,起报警作用
C.利用铁粉的吸附性除去食品袋里的氧气
D.臭氧消毒柜将转化成,这个过程发生了氧化还原反应
2.下列物质不溶于水的是( )
A.胆矾: B.重晶石:
C.芒硝: D.绿矾:
3.下列离子在溶液中不能大量存在的是( )
A. B. C. D.
4.下列物质的主要成分不属于硅酸盐的是( )
选项 A B C D
文物
名称 镶金兽首玛瑙杯 元青花萧何月下追韩信图梅瓶 三彩凤首壶 坭兴陶茶叶罐
A.A B.B C.C D.D
5.下列化学用语表述正确的是( )
A.(黑色)磁性氧化铁: B.中子数为8的碳原子:
C.羟基的电子式: D.熔融状态下的电离方程式:
6.下列实验不能达到实验目的的是( )
A.制备乙烯 B.证明有漂白性 C.分离沙子和溶液 D.收集甲烷
7.传统燃油汽车正在向电动化、智能化、网联化方向转型,下列说法错误的是( )
A.车用芯片用硅作半导体材料
B.汽车中使用的橡胶、塑料属于有机高分子材料
C.燃油汽车排气管装催化转化器可以减少的排放
D.新能源汽车的电池属于二次电池,电池的充电和放电反应属于可逆反应
8.我国某大学团队利用有机物(M,结构如图)成功制备了有机框架材料。下列有关M的说法错误的是( )
A.能与发生加成反应 B.能使酸性高锰酸钾溶液褪色
C.M与溶液反应最多消耗 D.M分子中存在分子内氢键
9.设为阿伏加德罗常数的值。和在一定条件下发生反应:下列叙述错误的是( )
A.上述反应生成时断裂键的数目为
B.(标准状况)还原剂反应时转移的电子数为
C.(标准状况)参与反应时生成氧化产物的分子数为
D.常温下, 2参与反应时,生成还原产物的分子数为
10.在不同条件下,反应的反应历程如图所示。下列说法正确的是( )
A.反应
B.由图可知,催化剂能降低反应的活化能
C.在催化剂的作用下,过程③为反应的控速步骤
D.该反应从原理上不能设计成原电池
11.短周期主族元素X、Y、Z、W的原子序数依次增大,基态Y原子有3个未成对电子,基态Z原子的价电子数等于其电子层数,这四种元素可形成离子化合物。下列叙述正确的是( )
A.氧化性: B.电负性:
C.的空间结构为平面三角形 D.第一电离能:
12.海水提取镁的主要过程如下,下列叙述正确的是( )
已知:液态亚硫酰氯()遇水生成两种酸性气体,其中一种能使品红溶液褪色。镁晶胞如图所示。
A.试剂1、试剂2分别为澄清石灰水、盐酸
B.操作1、操作2都用到了酒精灯、烧杯和漏斗
C.生成的反应是嫡增过程
D.通电时,转移电子,生成镁晶胞的数目约为
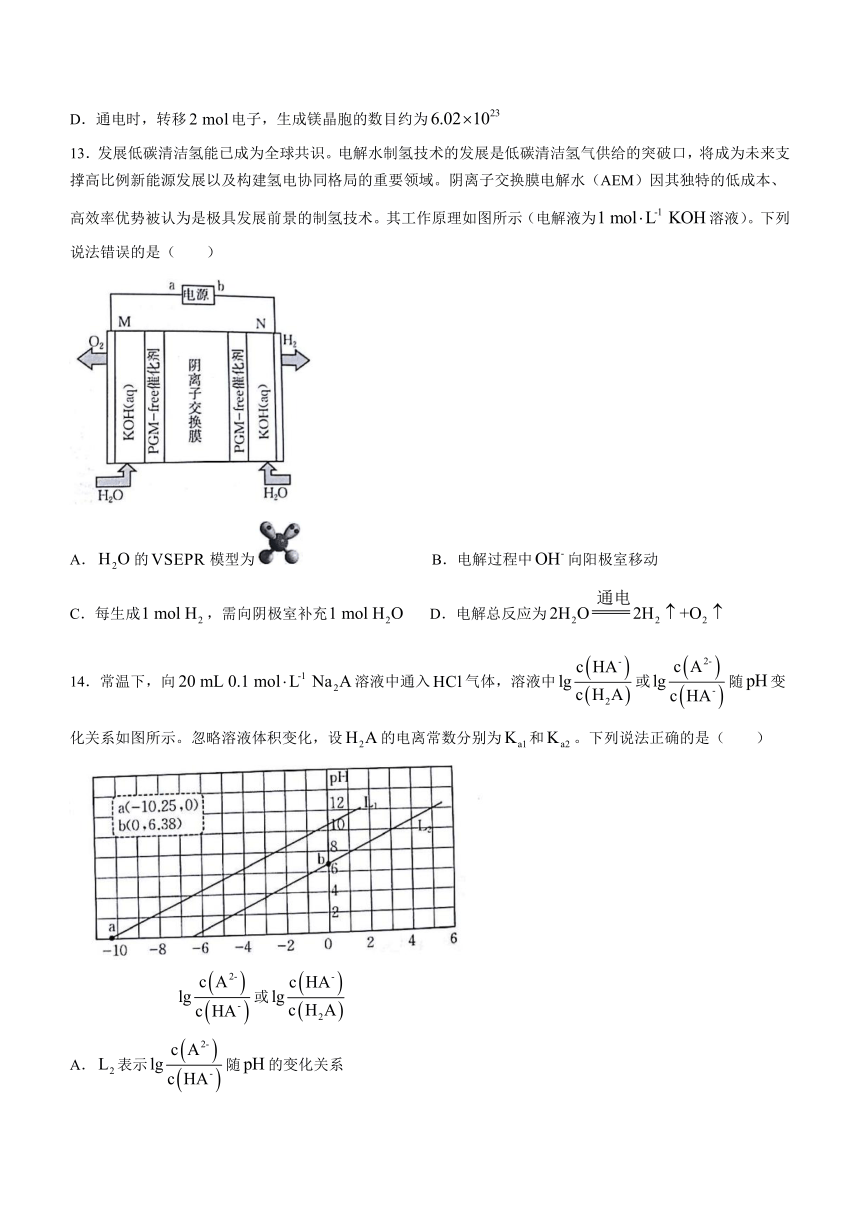
13.发展低碳清洁氢能已成为全球共识。电解水制氢技术的发展是低碳清洁氢气供给的突破口,将成为未来支撑高比例新能源发展以及构建氢电协同格局的重要领域。阴离子交换膜电解水(AEM)因其独特的低成本、高效率优势被认为是极具发展前景的制氢技术。其工作原理如图所示(电解液为溶液)。下列说法错误的是( )
A.的模型为 B.电解过程中向阳极室移动
C.每生成,需向阴极室补充 D.电解总反应为
14.常温下,向溶液中通入气体,溶液中或随变化关系如图所示。忽略溶液体积变化,设的电离常数分别为和。下列说法正确的是( )
或
A.表示随的变化关系
B.通入时,溶液中
C.当溶液呈中性时,
D.当溶液的时,溶液中
二、非选择题:本题共4小题,共58分。
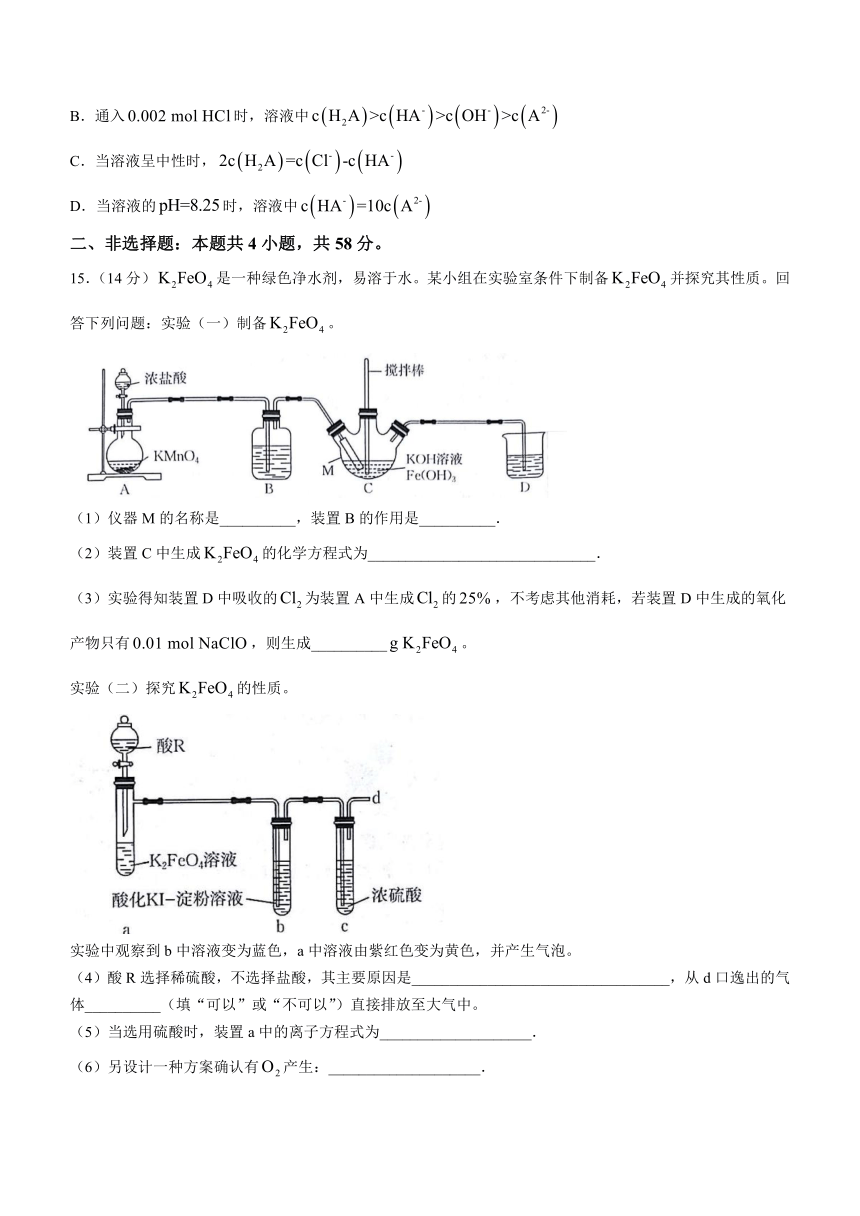
15.(14分)是一种绿色净水剂,易溶于水。某小组在实验室条件下制备并探究其性质。回答下列问题:实验(一)制备。
(1)仪器M的名称是__________,装置B的作用是__________.
(2)装置C中生成的化学方程式为______________________________.
(3)实验得知装置D中吸收的为装置A中生成的,不考虑其他消耗,若装置D中生成的氧化产物只有,则生成__________。
实验(二)探究的性质。
实验中观察到b中溶液变为蓝色,a中溶液由紫红色变为黄色,并产生气泡。
(4)酸R选择稀硫酸,不选择盐酸,其主要原因是__________________________________,从d口逸出的气体__________(填“可以”或“不可以”)直接排放至大气中。
(5)当选用硫酸时,装置a中的离子方程式为____________________.
(6)另设计一种方案确认有产生:____________________.
16.(14分)以固体为原料制备纯,其部分实验过程如下:
已知:①;
②;
③有两性,遇氨水会生成
(1)为二元强酸,写出“氧化”时主要发生反应的离子方程式:____________________。
(2)“氧化”时易产生一种黄绿色的有毒气体,该气体的化学式为____________________。
(3)若“氧化”不充分会导致“沉钯”时的产率降低,原因可能是____________________;
氧化液中的浓度一定,为提高的产率,“沉钯”时需控制的条件有反应的温度、__________。
(4)在配合物中,提供空轨道的元素为__________。
(5)可将溶液还原得到金属,同时产生一种温室气体,写出反应的化学方程式:____________________。标准状况下,1体积的钯粉大约可吸附896体积的氢气形成一种氢化物(钯粉的密度为,的相对原子质量为106.4),据此可知该种钯()的氢化物的化学式为____________________。若用代替还原,消耗的质量比理论值略高,其原因是______________________________。
17.(15分)氨是一种重要的化工原料,可用于制造铵态化肥。已知:
。回答下列问题:
(1)已知上述反应的嫡变()为。该反应能自发进行的温度可能是__________(填标号)。
A. B. C. D.
(2)在恒温恒容条件下,充入等物质的量的和合成氨气,下列情况表明该反应达到平衡状态的是__________(填标号)。
A.混合气体密度不随时间变化 B.体积分数不随时间变化
C.混合气体总压强不随时间变化 D.与的消耗速率之比为
(3)在催化剂作用下,合成氨的反应速率为(k为速率常数,只与温度、催化剂有关,与浓度无关。、、为反应级数,可取正整数、负整数、0,也可取分数)。为了测定反应级数,在一定温度下进行实验,其结果如下:
序号 反应速率
I 1 1 1
II 2 1 1
III 1 4 2
IV 1 4 2
①_________。
②已知经验公式为(其中,、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得与温度()的关系如图所示。
催化效率较高的是_________(填“”或“”),在催化剂作用下,活化能为_________。
(4)在体积均为的甲、乙两恒容密闭容器中分别通入和,分别在不同条件下达到平衡,测得的物质的量与时间的关系如图所示。
①相对甲,乙仅改变的一个条件是__________,正反应速率:a__________(填“>”、“<”或“=”)b。
②在该条件下,乙的平衡常数为__________(结果保留2位小数)。
18.(15分)有机化合物Ⅷ的合成路线如图,请根据所学知识回答下列问题。
已知:①I中含有羧基;
②
③VII的结构简式为。
(1)化合物I的名称为__________。
(2)化合物Ⅲ的结构简式为__________;根据其结构特征,分析其可能的化学性质,完成下表。
序号 反应试剂、条件 反应形成的新结构 反应类型
a ①__________ ②__________
b 银氨溶液、加热 ③__________ 氧化反应(生成有机物)
(3)Ⅲ→IV的反应__________(填“是”或“不是”)理想的原子经济性反应;IV中含有的官能团为____________________。
(4)IV→V的反应方程式为____________________。
(5)V→IV的过程中断裂的化学键类型为__________(从电子云重叠情况分析)键和键。
(6)化合物I和化合物Ⅷ中手性碳原子数__________(填“相同”或“不相同”,下同)。碳原子杂化轨道类型__________。
(7)化合物X为化合物Ⅲ的同分异构体,写出符合下列条件的X的结构简式:____________________(只写一种)。
①不含环状结构;
②能发生银镜反应;
③在核磁共振氢谱上只有3组峰。
白银市部分高中2023-2024学年高三上学期10月阶段检测联考
化学参考答案
1.B 2.B 3.D 4.A 5.D 6.A 7.D 8.C 9.C 10.B 11.B 12.C 13.C 14.C
15.(1)三口烧瓶(或三颈烧瓶,1分);吸收HC1,防止消耗掉装置C中的反应物(2分)
(2)(2分)
(3)3.96(2分)
(4)高铁酸钾与盐酸反应会生成氯气,污染环境(2分);可以(1分)
(5)(2分)
(6)用镊子夹一根带火星的木条放在d处,木条复燃(或其他合理答案,2分)
16.(1)(2分)
(2)(1分)
(3)未被氧化的在碱性条件下转化为,易形成可溶性的(2分);的用量(或反应时溶液的,2分)
(4)(1分)
(5)(2分);(2分);钯是一种优良的储氢金属,由于钯吸收储存了部分氢气,所以消耗的质量比理论值略高(2分)
17.(1)AB(2分) (2)CD(2分)
(3)①3(2分) ②(1分);30.0(2分)
(4)①降低温度(2分);>(2分) ②8.33(2分)
18.(1)溴乙酸(或溴乙酸,1分)
(2) (1分)
①、催化剂(1分)
②加成反应(或还原反应,1分)
③(或,2分)
(3)是(1分);酮羰基(或羰基,1分)
(4) (2分)
(5)(1分)
(6)相同(1分);相同(1分)
(7) (或其他合理答案,2分)
图片资源预览