四川省绵阳南山中学2023-2024学年高一下学期期末热身化学试卷(PDF版含答案)
2024-06-27 18:47:34 学考宝 作者:佚名
Word文档版
学考宝(xuekaobao.com)友情提示:html格式不完整,如有需要请根据文末提示下载并进行二次校对Word文档。
秘密★启用前
2024 年 6 月
绵阳南山中学 2024 年春季 2023 级期末统考热身考试
化学试题
本试卷分为试题卷和答题卡两部分,其中试题卷由第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)组成,共 6
页;答题卡共 2 页。满分 100 分,考试时间 75 分钟。
注意事项:
1. 答题前,考生务必将自己的班级、姓名用 0.5 毫米黑色墨水签字笔填写清楚,同时用 2B 铅笔将考
号准确填涂在“考号”栏目内。
2. 选择题使用 2B 铅笔填涂在答题卡对应题目标号的位置上,如需改动,用橡皮擦擦干净后再选涂其
它答案;非选择题用 0.5 毫米黑色墨水签字笔书写在答题卡的对应框内,超出答题区域书写的答案无效;
在草稿纸、试题卷上答题无效。
3.考试结束后将答题卡收回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Fe 56
第Ⅰ卷 选择题
一、选择题(本题包括 14小题,每小题 3分,共 42分。每小题只有一个选项最符合题意)
1.下列有关“中华文明”说法错误的是
A.鹳鱼石斧图彩绘陶缸是以黏土为主要原料,经高温烧结而成的
B.镶金兽首玛瑙杯的材质是极其稀有的缠丝玛瑙,玛瑙的主要成分为 SiO2
C.5G-A 技术闪耀世界,光导纤维的主要成分为高纯硅
D.“天街小雨润如酥,草色遥看近却无”,pH<5.6 的雨水为酸雨,会对植物造成巨大危害
2.下列劳动实践与化学知识没有关联的是
选项 劳动实践 化学知识
A 净化泉水:取泉水并添加适量的明矾 明矾水解产生胶体
B 烘焙糕点:加入小苏打做膨松剂 NaHCO3 固体溶于水吸热
C 种植瓜果:施肥时,将碳酸氢铵埋入土壤中 NH4HCO3受热易分解
D 泳池消毒:向游泳池撒漂白精 含氯消毒剂有强氧化性
3.下列关于金属冶炼的说法正确的是
A.通常采用 CO 高温还原法冶炼金属铁
B.冶炼金属的方法本质上是由金属在自然界的含量决定的
C.铜的湿法冶炼是将金属钠投入到CuSO4溶液中,从而置换出铜
D.用海水为原料制得精盐,再电解纯净的 NaCl 溶液可制得金属钠
4.下列说法不正确的是
A.通过煤的干馏和石油催化重整可获取芳香烃
B.通过石油催化裂化可以提高汽油的产量和质量
C.石油加工中减压蒸馏可避免温度过高造成的物质分解
D.分馏、蒸馏、煤的液化都是物理变化
试卷第 1 页,共 6 页
5.用 NA表示阿伏伽德罗常数的值,下列说法正确的是
A.17gNH3 通入水中充分反应,溶液中 NH3·H2O 分子数为 NA
B.常温常压下,100g46%的乙醇溶液中,含 H-O 键的数目为 NA
C.现有乙烯和丙烯的混合气体共 14g,其原子总数为 3NA
D.含2mol H2SO4 的浓硫酸与足量铜在加热条件下反应,生成SO2 数目为NA
6.工业上制备下列物质的生产流程不.合.理.的是
提纯
A.由铝土矿冶炼铝:铝土矿 →Al2O
H Cl3 →AlCl3
电 解 →Al
.由黄铁矿制硫酸:黄铁矿 煅 烧 →SO 催 化 氧化 →SO 9 8%浓 硫 酸吸B 2 3
收→H2SO4
C.工业制硝酸:N2 → NH3 → NO → NO2 → HNO3
焦炭 HCl H
D.由石英砂制高纯硅:石英砂 →粗硅 →SiHCl 2 →高温 加热 3 高温 纯硅
7.糖类、油脂和蛋白质是非常重要的营养物质,下列说法正确的是
A.淀粉和纤维素都属于多糖,都能在人体内被消化以提供能量
B.淀粉和纤维素都可用于生产乙醇
C.乙酸乙酯是一种简单的油脂
D.糖类、油脂、蛋白质完全燃烧,生成的产物相同
8.有机物 M( )是有机合成的一种中间体。下列关于 M 的说法错误的是
A.分子式为C9H12O3 B.含有 3 种官能团
C.加热可以和O2在铜催化下反应 D.分子中所有碳原子可能共平面
9.X、Y、Z、W 四种短周期元素位于三个不同的周期,且四种元素原子序数依次增大。其中,Y、Z 同周
期。它们能形成结构如图所示的分子,下列说法正确的是
A.氢化物的沸点 Z 一定高于 Y
B.X、Z、W 可以形成含共价键的离子化合物
C.原子半径 Z > W > Y > X
D.W 元素形成的单质常温下易溶于酒精,微溶于水
10.锌-空气电池(原理如图)适宜用作城市电动车的动力电源。该电池放电时Zn 转化为ZnO。该电池工作
时,下列说法不正确的是
A.K+向石墨电极移动
B.石墨电极的电极附近溶液的 pH 升高
C.电子由Zn 极流出到石墨电极,再经溶液回到Zn 极,形成回路
D.Zn 电极发生的电极反应方程为:Zn - 2e- + 2OH- = H2O + ZnO
11.下列有关离子方程式的书写错误的是
Δ
+ -
A.向硫酸氢铵溶液中加入足量的氢氧化钠溶液并加热:NH4 +OH NH3 +H2O
2 +
B.向稀硫酸溶液中加入Na2S2O3固体出现黄色沉淀:S2O3 + 2H = S +SO2 +H2O
C.向酸性 K Cr 2- + 3+ 2-2 2O7 溶液中通入SO2 :3SO2 + Cr2O7 + 2H = 2Cr + 3SO4 + H2O
2+
D.醋酸滴在大理石上产生气泡:2CH3COOH +CaCO3 = Ca + 2CH3COO +H2O+CO2
12.“吹出法”提溴工艺流程示意图如下:下列说法不.正.确.的是
A.“氧化”过程中 Cl2 使Br - 转化为 Br2
B.“吹出”过程中利用了 Br2 的挥发性
C.“吸收”过程中化学方程式:
Br2 +SO2 +2H2O=2HBr+H2SO3
D.“蒸馏”的目的是得到液溴
试卷第 2 页,共 6 页
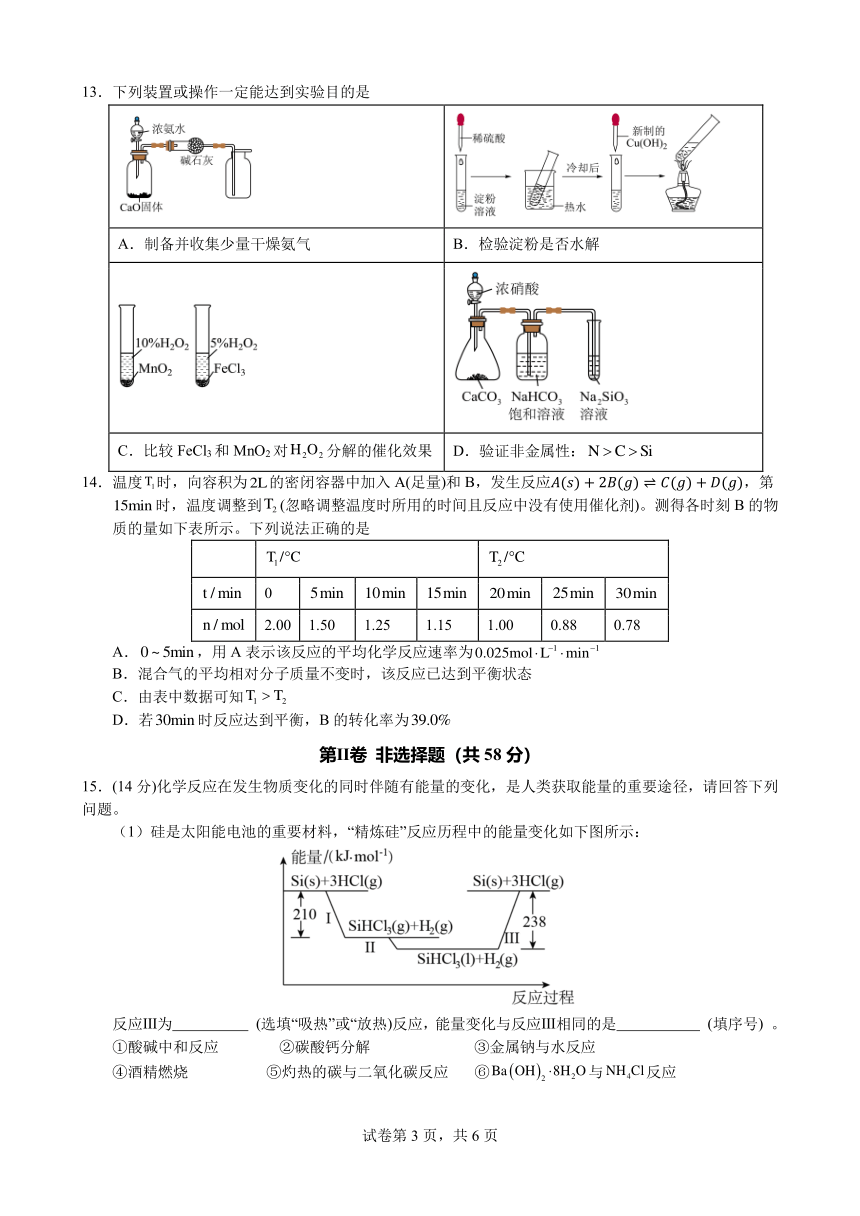
13.下列装置或操作一定能达到实验目的是
A.制备并收集少量干燥氨气 B.检验淀粉是否水解
C.比较 FeCl3和 MnO2对H2O2 分解的催化效果 D.验证非金属性:N C Si
14.温度T1时,向容积为2L的密闭容器中加入 A(足量)和 B,发生反应 ( ) + 2 ( ) ( ) + ( ),第
15min 时,温度调整到T2 (忽略调整温度时所用的时间且反应中没有使用催化剂)。测得各时刻 B 的物
质的量如下表所示。下列说法正确的是
T1 / C T2 / C
t / min 0 5min 10min 15min 20min 25min 30min
n / mol 2.00 1.50 1.25 1.15 1.00 0.88 0.78
A.0 ~ 5min,用 A 表示该反应的平均化学反应速率为0.025mol L 1 min 1
B.混合气的平均相对分子质量不变时,该反应已达到平衡状态
C.由表中数据可知T1 T2
D.若30min 时反应达到平衡,B 的转化率为39.0%
第Ⅱ卷 非选择题(共 58 分)
15.(14 分)化学反应在发生物质变化的同时伴随有能量的变化,是人类获取能量的重要途径,请回答下列
问题。
(1)硅是太阳能电池的重要材料,“精炼硅”反应历程中的能量变化如下图所示:
反应Ⅲ为 (选填“吸热”或“放热)反应,能量变化与反应Ⅲ相同的是 (填序号) 。
①酸碱中和反应 ②碳酸钙分解 ③金属钠与水反应
④酒精燃烧 ⑤灼热的碳与二氧化碳反应 ⑥Ba (OH) 8H NH Cl2 2O与 4 反应
试卷第 3 页,共 6 页
(2)为了减轻大气污染,可将汽车尾气中CO和NO转化为无污染气体。在一定条件下,向一容积为VL
的 恒 容 密 闭 容 器 中 充 入 10molCO、10molNO , 使 之 在 催 化 剂 作 用 下 发 生 反
应 催 化 剂 ,测得反应过程中部分物质的物质的量随反应时间变化
的曲线如图所示。
①由图中数据分析,表示N2 的物质的量随时间变化的曲线为 (填“Ⅰ”“Ⅱ”或“Ⅲ”);
0 2min 内,N2 (g)的平均反应速率为 mol L 1 min 1。
②根据图示可知,表示正反应速率与逆反应速率相等的点是 (填“a”、“b”、“c”或“d”);
用同一物质表示反应速率时,a 点的正反应速率 (填“大于”、“小于”或“等于”) c 点的逆反
应速率。
③反应达到平衡时,CO的转化率为 ;设平衡时容器内压强为p,反应起始时容器内压
强为p0 ,则p : p0 = 。
④若在容积固定的绝热容器中发生上述反应,不能说明该反应已达到平衡状态的是 (填
字母)。
A.容器内温度不再变化
B.容器内的气体压强保持不变
C.2v 逆(NO)=v 正(N2)
D.容器内混合气体的密度保持不变
16.(14 分)很多重要的工业原料来源于石油化工,结合下图回答有关问题:
(1)丙烯酸中含氧官能团的名称为 。
(2)写出下列反应的反应类型:① 、③ (填标号)。
a.氧化反应 b.加成反应 c.取代反应 d.加聚反应 e.酯化反应
(3)丙烯不可能发生的反应有 (填标号)。
a.加成反应 b.取代反应 c.加聚反应 d.中和反应 e.氧化反应
(4)写出下列反应的化学方程式
A→B: 。
丙烯酸+B→丙烯酸乙酯: 。
反应④: 。
试卷第 4 页,共 6 页
(5)烃 A 中,当有一个 H 被一个甲基取代后,最多有 个原子共面。
(6)丙烯酸乙酯的同分异构体中,写出满足下列条件的所有同分异构体的结构简式 。
①与丙烯酸互为同系物②分子中含有两个甲基
17.(14 分)亚硝酸钠常用作防腐剂,某化学兴趣小组设计如图装置制备亚硝酸钠(部分夹持装置略,气密性
已检验)。
已知:ⅰ. 2NO+Na2O2 =2NaNO2 ,亚硝酸钠是白色固体,易潮解,易溶于水。
ⅱ. 2NO2 +Na2O2 =2NaNO3
ⅲ.酸性条件下,NO或NO
2 都能与MnO
4 反应生成NO3 和Mn
2+。
实验操作及现象:
操作 现象
A 中铜片表面产生红棕色气泡,逐渐充满容器;
ⅰ.关闭弹簧夹,打开分液漏斗活塞,滴加适量浓硝酸。 B 中刚开始时液面上方略显浅棕色并逐渐消失;
……
ⅱ.打开弹簧夹,通入N2 一段时间。
回答下列问题:
(1)A 装置中盛有浓硝酸的仪器名称为 。A 中发生反应的离子方程式为 。
(2)装置 E 中碱石灰的作用是 。
(3)上述装置存在一处缺陷,不符合绿色化学的理念,改进的方法是 。
(4) 当观察到 现象时,可以进行操作ⅱ。
(5)分析反应后 D 中白色固体的组成。
①从 D 中取白色固体,滴加酸性KMnO4 溶液,发生反应的离子反应方程为 ,证明固体
中存在NaNO2。
②甲同学认为固体中可能存在硝酸钠,理由是装置中空气参与反应。请从实验现象中找出该同学判断
的依据为 ,该同学设计方案解决该问题,进行的操作为:a……;b.关闭弹簧夹,打开分液
漏斗活塞,滴加适量浓硝酸;c…… 则操作 a 是 。
18.(16 分)将黄铁矿(主要成分FeS2 ,含杂质SiO2 等)在空气中焙烧,产生红渣以及气体 a,再经过一系列
处理制备铵铁蓝 Fe(NH4 )Fe(CN) 6 颜料,工艺流程如下:
试卷第 5 页,共 6 页
(1)写出黄铁矿焙烧的化学方程式 ;为提高焙烧的效率,可以采取的措施
为 。
A.进一步粉碎矿石 B.通入适当过量的空气 C.降低焙烧的温度
写出气体 a 的一种用途 。
(2)在“还原”过程中,不会生成 S 单质和气体,写出该过程中反应的离子方程式 。
(3)在“沉铁”过程中会产生白色沉淀Fe(NH4 ) Fe (CN) ,该物质中Fe的化合价为 ,则“氧2 6
化”过程中加入NaClO3 的作用是 。
(4)在“洗涤”过程中检验沉淀已洗涤干净的操作及现象是 。
(5)“还原”过程中得到的滤液可用于制备绿矾( FeSO4 7H2O )。在 N2 氛围中,FeSO4 7H2O 的脱水热分
解过程如图所示:
根据上述实验结果,可知 x= , y= 。
试卷第 6 页,共 6 页
秘密★启用前
2024 年 6 月
绵阳南山中学 2024 年春季 2023 级期末统考热身考试
化学参考答案
第Ⅰ卷 选择题(共 42 分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 C B A D C A B D B C A C D B
第Ⅱ卷 非选择题(共 58 分)
15.(14 分)(1)吸热 (1 分) ②⑤⑥(2 分)
1.25
(2)① Ⅱ (1 分) (2 分)
V
②d (1 分)大于(1 分)
③ 80% (2 分) 4∶5(2 分) ④ CD(2 分)
16.(14 分)(1)羧基(1 分)
(2) c (1 分) a (1 分) (3)d(1 分)
催化剂
(4) CH2=CH2+H2O————→CH3CH2OH (2 分)
加热、加压
浓硫酸
CH2=CH-COOH+CH3CH2OH CH2=CH-COOCH2CH3+H2O (2 分)
△
催化剂
nCH2=CH-COOH ———→ (2 分)
△
(5)7 (2 分)
(6) (1 分) (1 分)
17.(14 分)(1)分液漏斗(1 分) Cu + 4H+ + 2NO -3 = Cu2+ + 2NO2↑+ 2H2O(2 分)
(2)防止空气进入 D 中干扰实验(2 分)
(3)在 E 后接盛有酸性KMnO4 溶液的洗气瓶或气囊(2 分)
(4) D 中固体由淡黄色全部转变为白色(2 分)
NO MnO + 2+ NO (5) 5 2 + 2 4 + 6H = 2 Mn + 5 3 +3H2O(2 分) B 中刚开始时液面上方略显浅棕色并逐渐
消失(1 分) 打开弹簧夹,通N2 一段时间(2 分)
焙烧
18.(16 分)(1) 4FeS2 +11O2 2Fe2O3 +8SO2 (2 分) AB(2 分) 制硫酸、漂白剂、食品添加剂等(1 分)
14Fe3+ +FeS +8H O=15Fe2+(2) 2 2 +2SO
2-
4 +16H
+
(2 分)
(3) +2 (1 分) 将 Fe(NH4)2Fe(CN)6氧化为 Fe(NH4)Fe(CN)6(2 分)
(4)取最后一次洗涤液少许于试管中,加入BaCl2溶液,无白色沉淀(或做焰色试验,火焰无黄色)(2 分)
(5) 4(2 分) 1(2 分)
试卷第 1 页,共 1 页
图片资源预览