2024届高考化学一轮复习教案 03 第一章 第3讲 离子反应的应用
2023-12-12 18:17:58 学考宝 作者:佚名
Word文档版
学考宝(xuekaobao.com)友情提示:html格式不完整,如有需要请根据文末提示下载并进行二次校对Word文档。
第3讲 离子反应的应用
[课程标准] 1.了解离子反应发生条件,正确判断常见离子在溶液中能否大量共存。2.掌握常见离子的检验,能根据实验现象推断溶液中的离子。
考点一 离子共存
离子不能共存的“四种”类型
类型一 复分解反应型
生成难溶物或微溶物的离子不能大量共存
阴离子 不能大量共存的阳离子
OH- Mg2+、Al3+、Ca2+、Fe3+、Fe2+、Cu2+
Cl-、Br-、I- Ag+
SO Ba2+、Pb2+、Ag+
S2- Cu2+、Pb2+、Ag+
CO、SO Mg2+、Ca2+、Ba2+、Ag+
SiO H+、Mg2+、Ca2+
AlO H+
类型二 氧化还原反应型
具有较强氧化性离子与具有较强还原性离子,会发生氧化还原反应而不能大量共存。
(1)氧化性较强的离子:ClO-、MnO(H+)、NO(H+)、Fe3+、Cr2O、FeO。
(2)还原性较强的离子:Fe2+(可与Fe3+共存)、S2-、I-、SO、HS-、HSO。
类型三 水解相互促进型
当弱酸的酸根与弱碱的阳离子同时存在于水溶液中时,弱酸的酸根水解生成的氢氧根离子与弱碱的阳离子水解生成的氢离子反应生成水,从而使两种离子的水解平衡互相促进而向水解方向移动,甚至完全反应。常见的因发生相互促进的水解反应而不能大量共存的离子如下:
(1)Al3+与CO、HCO、S2-、HS-、AlO、SiO、ClO-;
(2)Fe3+与CO、HCO、AlO、SiO、ClO-;
(3)NH与AlO、SiO。
类型四 络合反应型
离子间因发生络合反应而不能大量共存,中学常见的反应有
(1)Fe3+与SCN-因生成Fe(SCN)3而不能大量共存。
(2)Ag+与NH3·H2O因生成[Ag(NH3)2]+而不能大量共存。
(3)Cu2+与NH3·H2O因生成[Cu(NH3)4]2+而不能大量共存。
INCLUDEPICTURE "核心突破.TIF" INCLUDEPICTURE "E:2024《金版新学案》高三总复习 新教材 化学 人教版(双选)B图片1核心突破.TIF" * MERGEFORMATINET
一、判断离子共存,注意“题干”限制条件
1.下列各组离子在溶液中因发生复分解反应而不能大量共存的是 。
①Na+、H+、CH3COO-、Cl-
②Ba2+、Na+、CO、NO
③Na+、HCO、H+、NO
④Al3+、Fe3+、NO、SO
⑤K+、Na+、AlO、NO
⑥Na+、H+、Cl-、OH-
⑦Cu2+、Fe2+、Cl-、SO
⑧K+、Na+、SiO、NO
答案: ①②③⑥
2.下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是 。
①Na+、H+、CO、Cl-
②H+、NO、Fe2+、Na+
③Na+、Fe3+、I-、Cl-
④H+、S2-、SO、SO
⑤SO、NO、Na+、H+
⑥I-、ClO-、K+、H+
⑦Na+、K+、MnO、Cl-
⑧Fe3+、Ca2+、H+、NO
答案: ②③④⑥
3.下列各组离子因水解相互促进而不能大量共存的是 。
①Al3+、HCO、Cl-、K+
②Al3+、SiO、Na+、Cl-
学生用书?第12页
③Fe3+、NH、SO、S2-
④Fe3+、Cl-、Na+、CO
⑤Al3+、Fe3+、SCN-、Cl-
⑥Na+、Al3+、NO、AlO
⑦Na+、Ca2+、HCO、HSO
⑧S2O、Na+、H+、SO
⑨Na+、Al3+、SO、S2-
答案: ①②④⑥⑨
二、判断离子共存,注意“选项”限制条件
4.下列各组离子在指定的溶液中,一定能大量共存的打“√”,不能大量共存的打“×”。
(1)c(H+)水=10-12 mol·L-1的溶液:Na+、K+、CO、SO( )
(2)使酚酞变红色的溶液:Na+、Cu2+、Fe2+、NO( )
(3)常温下,pH=12的溶液:K+、Cl-、SO( )
(4)c(H+)=0.1 mol·L-1的溶液:Na+、NH、SO、S2O( )
(5)使pH试纸显蓝色的溶液:Cu2+、NO、Fe3+、SO( )
(6)与铝粉反应放出H2的无色溶液:NO、Al3+、Na+、SO( )
(7)使红色石蕊试纸变蓝的溶液:SO、CO、Na+、K+( )
(8)常温下,=1×10-12的溶液:K+、AlO、CO、Na+( )
(9)中性溶液:Fe3+、Al3+、NO、SO( )
(10)使甲基橙变红色的溶液:Mg2+、K+、SO、SO( )
答案: (1)× (2)× (3)√ (4)× (5)× (6)× (7)√ (8)√ (9)× (10)×
溶液中离子共存的判断技巧
1.审清题干要求的关键词语,如“一定大量共存”“可能大量共存”或“不能大量共存”等。
2.规避颜色陷阱,如“无色溶液”“透明溶液”等。
3.注意离子共存的条件,如酸性、碱性及特殊离子存在。
考点二 离子的检验
INCLUDEPICTURE "要点梳理.TIF" INCLUDEPICTURE "E:2024《金版新学案》高三总复习 新教材 化学 人教版(双选)B图片1要点梳理.TIF" * MERGEFORMATINET
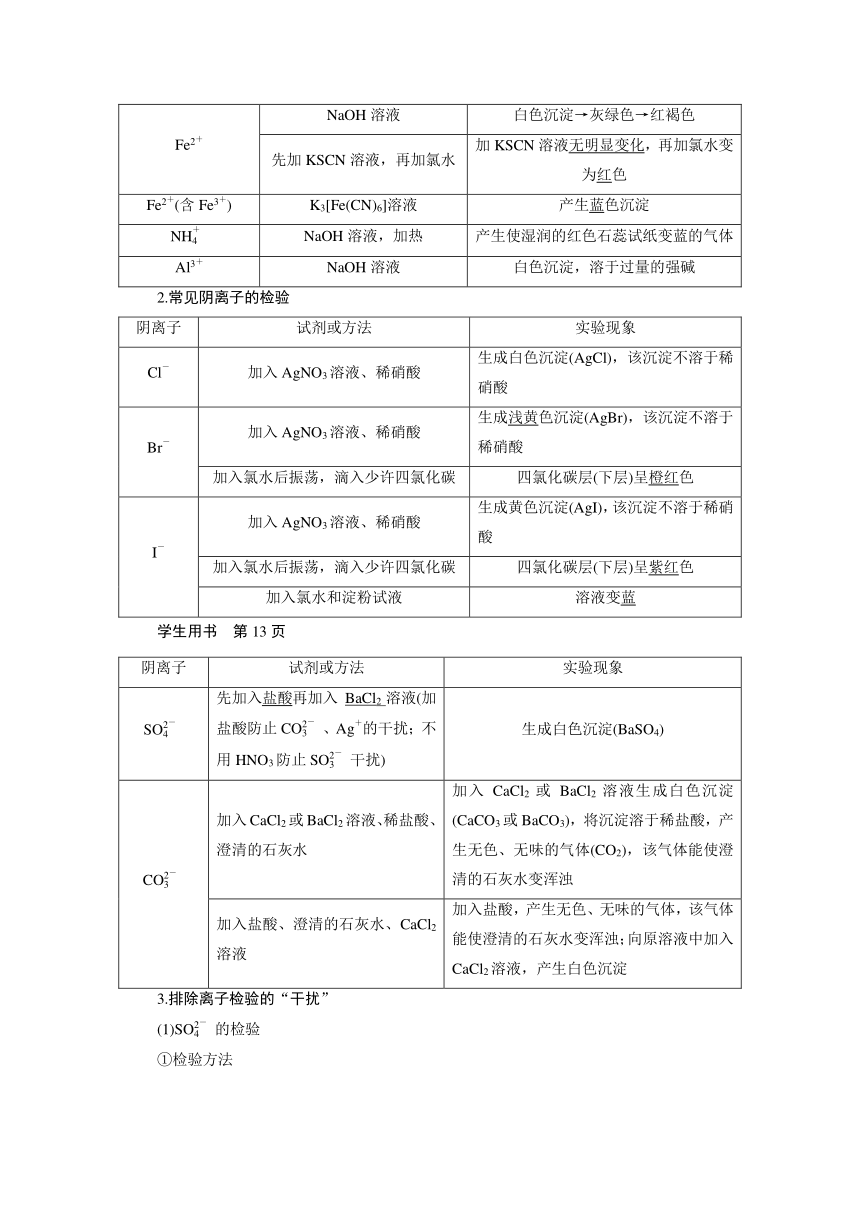
1.常见阳离子的检验
阳离子 试剂或方法 实验现象
Na+ 焰色试验 黄色火焰
K+ 焰色试验 紫色火焰(透过蓝色钴玻璃)
Fe3+ NaOH溶液 生成红褐色沉淀
KSCN溶液 溶液呈红色
Fe2+ NaOH溶液 白色沉淀→灰绿色→红褐色
先加KSCN溶液,再加氯水 加KSCN溶液无明显变化,再加氯水变为红色
Fe2+(含Fe3+) K3[Fe(CN)6]溶液 产生蓝色沉淀
NH NaOH溶液,加热 产生使湿润的红色石蕊试纸变蓝的气体
Al3+ NaOH溶液 白色沉淀,溶于过量的强碱
2.常见阴离子的检验
阴离子 试剂或方法 实验现象
Cl- 加入AgNO3溶液、稀硝酸 生成白色沉淀(AgCl),该沉淀不溶于稀硝酸
Br- 加入AgNO3溶液、稀硝酸 生成浅黄色沉淀(AgBr),该沉淀不溶于稀硝酸
加入氯水后振荡,滴入少许四氯化碳 四氯化碳层(下层)呈橙红色
I- 加入AgNO3溶液、稀硝酸 生成黄色沉淀(AgI),该沉淀不溶于稀硝酸
加入氯水后振荡,滴入少许四氯化碳 四氯化碳层(下层)呈紫红色
加入氯水和淀粉试液 溶液变蓝
学生用书?第13页
阴离子 试剂或方法 实验现象
SO 先加入盐酸再加入BaCl2溶液(加盐酸防止CO、Ag+的干扰;不用HNO3防止SO干扰) 生成白色沉淀(BaSO4)
CO 加入CaCl2或BaCl2溶液、稀盐酸、澄清的石灰水 加入CaCl2或BaCl2溶液生成白色沉淀(CaCO3或BaCO3),将沉淀溶于稀盐酸,产生无色、无味的气体(CO2),该气体能使澄清的石灰水变浑浊
加入盐酸、澄清的石灰水、CaCl2溶液 加入盐酸,产生无色、无味的气体,该气体能使澄清的石灰水变浑浊;向原溶液中加入CaCl2溶液,产生白色沉淀
3.排除离子检验的“干扰”
(1)SO的检验
①检验方法
②排除干扰
Ag+的干扰:先用盐酸酸化,能防止Ag+干扰;
CO、SO的干扰:因为BaCO3、BaSO3也是白色沉淀,与BaSO4白色沉淀不同的是这些沉淀能溶解于盐酸中,因此检验SO时,必须用盐酸酸化(不能用HNO3、H2SO4酸化)。
(2)CO的检验
①检验方法
②排除干扰
HCO、HSO的干扰 若被检液中不含CO而含有HCO(或HSO ),则加入CaCl2(或BaCl2)溶液时不会产生白色沉淀,故可用BaCl2(或CaCl2)溶液排除干扰
SO的干扰 因为CaSO3与CaCO3一样,也是白色沉淀,且CaSO3也能与盐酸反应产生使澄清石灰水变浑浊的气体(SO2),但SO2是有刺激性气味的气体,故可用无色无味来排除SO的干扰
(3)Fe2+的检验
①溶液中只含Fe2+:可用KSCN溶液和氯水检验,不考虑干扰问题。
②溶液中含Fe2+、Fe3+,不含Cl-时,可加入酸性KMnO4溶液,溶液褪色,说明溶液中含有Fe2+,不能用KSCN溶液和氯水,原因是Fe3+会形成干扰。
③溶液中含有Fe2+、Fe3+、Cl-时,加入K3[Fe(CN)6](铁氰化钾)溶液,生成蓝色沉淀,不能用酸性KMnO4溶液,原因是Cl-有还原性,也能使酸性KMnO4溶液褪色,形成干扰。
(4)Cl-、SO共存的溶液
(5)CO、HCO共存的溶液
[正误辨析]
(1)加入稀盐酸酸化的BaCl2溶液,出现白色沉淀,则溶液中可能有SO或Ag+( )
(2)加入盐酸,产生白色沉淀,滴加硝酸白色沉淀不溶解,则溶液中有Ag+( )
学生用书?第14页
(3)滴入硝酸酸化的BaCl2溶液,产生白色沉淀,溶液中一定存在SO( )
(4)滴加KSCN溶液无现象,将所得溶液滴加饱和氯水,溶液无红色,则溶液中一定不存在Fe2+( )
(5)某溶液的焰色试验呈黄色,则溶液中一定有钠元素,不能确定是否有钾元素( )
(6)无色溶液加入CCl4无现象,滴加氯水后CCl4层呈紫红色,则溶液中一定存在I-( )
答案: (1)√ (2)× (3)× (4)√ (5)√ (6)√
INCLUDEPICTURE "核心突破.TIF" INCLUDEPICTURE "E:2024《金版新学案》高三总复习 新教材 化学 人教版(双选)B图片1核心突破.TIF" * MERGEFORMATINET
一、“操作、现象、结论”型判断
1.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
选项 操作 现象 结论
A 滴加BaCl2溶液 生成白色沉淀 原溶液中有SO
B 滴加硫酸 有刺激性气味的气体产生 原溶液中有SO
C 用洁净铂丝蘸取溶液进行焰色试验 火焰呈紫色(透过蓝色钴玻璃) 原溶液中有钾元素
D 滴加NaOH溶液,将湿润红色石蕊试纸置于试管口 试纸不变蓝 原溶液中无NH
C [A项加入BaCl2溶液得到白色沉淀,原溶液中可能含有SO或SO或Ag+;B项HSO也有同样的现象;C项观察钾的焰色试验应透过蓝色钴玻璃,排除钠的干扰;D项检验NH应加入浓NaOH溶液,且需要加热。]
2.下列有关离子检验的方法正确的是( )
A.加入硝酸银溶液,产生白色沉淀,原溶液中一定含有Cl-
B.加入氢氧化钠溶液立即有白色沉淀产生,原溶液中一定含有Al3+
C.加入稀盐酸,产生能使澄清石灰水变浑浊的气体,原溶液中一定含有CO
D.加入稀盐酸无现象,再加入氯化钡溶液有白色沉淀产生,原溶液中一定含有SO
D [某溶液中加入硝酸银溶液,产生白色沉淀,能够与硝酸银生成白色沉淀的离子不一定为Cl-,可能含有SO、CO,A错误;某溶液中加入氢氧化钠溶液立即有白色沉淀产生,该白色沉淀不一定为Al(OH)3,也可能为Mg(OH)2沉淀,所以原溶液中不一定有Al3+,B错误;某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体,该气体可能为CO2或SO2,该溶液中可能存在CO、HCO、SO、HSO等,因此不一定含有CO,C错误;某溶液中加入稀盐酸无现象,排除了Ag+、CO、SO等干扰,加入氯化钡溶液有白色沉淀产生,该白色沉淀为BaSO4,则该溶液中一定有SO,D正确。]
二、从定性、定量的角度推断离子或物质
3.某100 mL溶液可能含有Na+、NH、Fe2+、CO、SO、Cl-中的若干种,取该溶液进行连续实验,实验过程如图所示(所加试剂均过量,气体全部逸出),下列说法不正确的是( )
A.向原溶液中加K3[Fe(CN)6]溶液,无明显现象
B.原溶液中c(Cl-)≥0.1 mol·L-1
C.用洁净的铂丝蘸取原溶液,在酒精灯上灼烧,火焰呈黄色
D.将湿润的红色石蕊试纸靠近实验产生的气体,试纸变蓝
C [根据实验过程分析,向100 mL溶液中加入氯化钡溶液产生的沉淀1为4.30 g,加入盐酸后,沉淀2的质量为2.33 g,说明原溶液中含有CO、SO;向滤液中加入氢氧化钠溶液,产生气体,该气体为氨气,则原溶液中含有NH;所以原溶液中一定含有CO、SO、NH,一定不含Fe2+。原溶液中不含Fe2+,加入K3[Fe(CN)6]溶液,无明显现象,A项正确;硫酸钡沉淀的质量为2.33 g,n(SO)=n(BaSO4)==0.01 mol,n(CO)=n(BaCO3)==0.01 mol,n(NH)=n(NH3)==0.05 mol,根据电荷守恒可知,0.01×2+0.01×2<0.05×1,所以溶液中含有Cl-,溶液中可能含有阳离子Na+,则原溶液中c(Cl-)≥ mol·L-1,B项正确;溶液中不一定含Na+,火焰不一定呈黄色,C项错误;加入NaOH溶液后产生的气体为NH3,能够使湿润的红色石蕊试纸变蓝,D项正确。]
4.离子反应在实验室制备物质和工业生产中有着重要的作用。某无色溶液中可能含有Na+、Ba2+、Cl-、Br-、SO、SO中的若干种,依顺序进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤 操作 现象
① 用pH试纸检验 溶液的pH大于7
② 向①所得溶液中滴加新制氯水,再加入CCl4振荡,静置 CCl4层呈橙色
③ 向②所得水溶液中加入Ba(NO3)2溶液和稀硝酸 有白色沉淀产生
④ 向③的滤液中加入AgNO3溶液 有白色沉淀产生
请完成下列问题:
(1)根据步骤①可知,一定不存在的离子是 。
(2)步骤②发生反应的离子方程式为 _
、
。
(3)综合上述四步操作,无法确定是否存在的离子有 。
解析: 由步骤①结合盐类水解的知识可知,原溶液中一定有SO,则一定不含Ba2+。由步骤②CCl4层呈橙色可知,原溶液中含有Br-。步骤③中白色沉淀为BaSO4,可能为原溶液中含有的SO被氧化生成的SO与Ba2+反应产生的,因此,不能确定原溶液是否含SO。由步骤④可知,白色沉淀为AgCl,但是Cl-可能是加入新制氯水时引入的,因此,不能确定原溶液是否含有Cl-。根据溶液电荷守恒可知,原溶液中一定含有Na+。综上所述,原溶液中一定不存在的是Ba2+,一定存在的是SO、Br-、Na+,不能确定的是Cl-、SO。
答案: (1)Ba2+
(2)Cl2+SO+H2O===SO+2H++2Cl-
Cl2+2Br-===Br2+2Cl-
(3)Cl-、SO
学生用书?第15页
必做实验一 用化学沉淀法去除粗盐中的杂质离子
INCLUDEPICTURE "要点梳理.TIF" INCLUDEPICTURE "E:2024《金版新学案》高三总复习 新教材 化学 人教版(双选)B图片1要点梳理.TIF" * MERGEFORMATINET
1.粗食盐水中常含有的杂质离子:Ca2+、Mg2+、SO。
2.粗盐的除杂原理及规律
(1)原理
(2)路线
3.粗盐提纯过程中涉及的主要操作
1.加入试剂的顺序:BaCl2必须在Na2CO3之前加。
2.过滤之后再加入稀盐酸除去过量的Na2CO3和NaOH。
3.除去多种杂质时必须考虑加入试剂的顺序。
4.除杂时,每次所加试剂都要略微过量是为了将杂质离子完全除去。
INCLUDEPICTURE "核心突破.TIF" INCLUDEPICTURE "E:2024《金版新学案》高三总复习 新教材 化学 人教版(双选)B图片1核心突破.TIF" * MERGEFORMATINET
1.(2022·广东卷)实验室进行粗盐提纯时,需除去Ca2+、Mg2+和SO,所用试剂包括BaCl2以及( )
A.Na2CO3、NaOH、HCl
B.Na2CO3、HCl、KOH
C.K2CO3、HNO3、NaOH
D.Na2CO3、NaOH、HNO3
A [除杂过程中不能引入新杂质,同时为保证除杂完全,所加除杂试剂一般过量,然后选择合适的试剂将所加过量的物质除去。粗盐中主要成分为NaCl。除去Ca2+选用CO将其转化为沉淀,为了不引入新杂质,所加物质的阳离子为Na+,即选用Na2CO3除去Ca2+,同理可知,除去Mg2+需选用NaOH,除去SO需选用BaCl2,因所加除杂试剂均过量,因此向粗盐样品中加入除杂试剂的顺序中,BaCl2先于Na2CO3加入,利用Na2CO3除去Ca2+和多余的BaCl2,因Na2CO3、NaOH均过量,成为新杂质,需要过滤后向滤液中加入HCl,至溶液中不再有气泡产生,以此除去Na2CO3、NaOH,然后将溶液蒸干得到较为纯净的食盐产品。]
2.精制粗盐(杂质是MgCl2、CaCl2和Na2SO4),选用NaOH溶液、BaCl2溶液、Na2CO3溶液作为除杂试剂,最后用盐酸调节溶液pH,得到精制NaCl。下列说法正确的是( )
A.依次向粗盐溶液中加入NaOH、Na2CO3、BaCl2
B.用HNO3酸化的AgNO3溶液检验SO是否除尽
C.除去Ca2+的主要反应是:Ca2++2OH-===Ca(OH)2↓
D调节pH后,采用蒸发浓缩结晶的方法获得精制NaCl
D [碳酸钠一定在氯化钡之后,则依次向粗盐溶液中加入NaOH、BaCl2、Na2CO3或BaCl2、NaOH、Na2CO3或BaCl2、Na2CO3、NaOH,故A错误;检验SO的试剂为盐酸、氯化钡,则利用盐酸、氯化钡检验SO是否除尽,故B错误;钙离子转化为碳酸钙沉淀,则除去Ca2+的主要反应是:Ca2++CO===CaCO3↓,故C错误;NaCl溶液可蒸发得到晶体,则调节pH后,采用蒸发浓缩结晶的方法获得精制NaCl,故D正确。]
3.为除去粗盐中的Ca2+、Mg2+、Fe3+、SO以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如图(用于沉淀的试剂稍过量):
称取粗盐滤液精盐
(1)第⑤步实验操作需要烧杯、 等玻璃仪器。
(2)步聚⑦中蒸发结晶时会用到下列仪器中的 (填仪器名称)。
(3)除杂试剂Na2CO3、NaOH、BaCl2加入的顺序还可以是 (任写一种合理顺序即可)。
解析: (1)过滤装置是分离难溶性物质和溶液的分离方法,用到的玻璃仪器为烧杯、玻璃棒、漏斗;(2)粗盐提纯的步骤是溶解、过滤、蒸发、结晶,由步骤可推测用到的仪器是铁架台、漏斗、烧杯、玻璃棒、蒸发皿和酒精灯,会用到下列仪器中的蒸发皿;(3)除杂试剂为了完全除去杂质离子,一般是过量的,碳酸钠可以将钙离子以及过量的钡离子沉淀下
来,BaCl2、NaOH、Na2CO3加入的顺序必须满足BaCl2在Na2CO3之前加入,过滤后再加盐酸至不再有气体生成即可,除杂试剂加入的顺序可以是BaCl2、NaOH、Na2CO3或NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH。
答案: (1)玻璃棒、漏斗 (2)蒸发皿 (3)NaOH、BaCl2、Na2CO3(或BaCl2、Na2CO3、NaOH或BaCl2、NaOH、Na2CO3)
学生用书?第16页
答题规范1 离子反应的规范解答
实验操作(取少量或适量待检溶液于试管中,加入……试剂,再加入……试剂)
现象描述(①溶液由……变为……,②若有……生成,③若没有……等)
得出结论(如“若……说明……,若……说明……”)
应用1.为了探究AgNO3的氧化性,某化学兴趣小组设计了如下实验:
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验,可选用试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水。
请完成下表:
操作 现象 结论
取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 存在Fe3+
取少量除尽Ag+后的溶液于试管中,加入 ,振荡 存在Fe2+
[实验结论] Fe的氧化产物为Fe2+和Fe3+
解析: Fe3+遇KSCN溶液,溶液变红色。由于氯水与Fe2+反应,现象不明显,应直接用K3[Fe(CN)6]溶液检验,若有蓝色沉淀出现,则证明Fe2+存在,否则不存在。
答案: 溶液呈红色 K3[Fe(CN)6]溶液 产生蓝色沉淀
应用2.按要求回答下列问题:
(1)已知Na2S2O3·5H2O遇酸易分解:S2O+2H+===S↓+SO2↑+H2O
(供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液)
结晶析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论: _
。
(2)榴石矿石可以看作CaO、FeO、Fe2O3、Al2O3、SiO2组成。试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与现象)
。
答案: (1)取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤,取滤液)于一试管中,滴加BaCl2溶液,若产生白色沉淀则说明含有Na2SO4杂质(合理即可)
(2)取矿石少许,加稀硫酸充分反应后,向其中滴加酸性高锰酸钾溶液,若紫红色褪去,证明矿石中含有FeO(不能加盐酸溶解)
真题演练 明确考向
1.(2022·湖北卷)下列各组离子在给定溶液中能大量共存的是( )
A.在0.1 mol·L-1氨水中:Ag+、Cu2+、NO、SO
B.在0.1 mol·L-1氯化钠溶液中:Fe3+、I-、Ba2+、HCO
C.在0.1 mol·L-1醋酸溶液中:SO、NH、Br-、H+
D.在0.1 mol·L-1硝酸银溶液中:K+、Cl-、Na+、CO
C [氨水显碱性,会与Ag+、Cu2+反应,不能大量共存,A项错误;Fe3+、I-会发生氧化还原反应,不能大量共存,B项错误;醋酸显酸性,在醋酸溶液中SO、NH、Br-、H+均不会发生反应,能大量共存,C项正确;硝酸银中的银离子会与Cl-、CO反应生成沉淀,不能大量共存,D项错误。]
2.(2022·全国乙卷)某白色粉末样品,可能含有Na2SO4、Na2SO3、Na2S2O3和Na2CO3。取少量样品进行如下实验:
①溶于水,得到无色透明溶液。
②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出,离心分离。
③取②的上层清液,向其中滴加BaCl2溶液有沉淀生成。
该样品中确定存在的是( )
A.Na2SO4、Na2S2O3 B.Na2SO3、Na2S2O3
C.Na2SO4、Na2CO3 D.Na2SO3、Na2CO3
A [由题意可知,①取少量样品溶于水得到无色透明溶液,说明固体溶于水且相互之间能共存,②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体放出,说明固体中存在Na2S2O3,发生反应S2O+2H+===S↓+H2O+SO2↑,离心分离,③取②的上层清液,向其中滴加BaCl2溶液,有沉淀生成,则沉淀为BaSO4,说明固体中存在Na2SO4,不能确定是否有Na2SO3和Na2CO3, Na2SO3与过量盐酸反应生成二氧化硫,Na2CO3与过量盐酸反应生成二氧化碳,而这些现象可以被Na2S2O3与过量盐酸反应的现象覆盖掉,综上分析,该样品中确定存在的是:Na2SO4、Na2S2O3。]
3.(2021·湖南选择考,12)对下列粒子组在溶液中能否大量共存的判断和分析均正确的是( )
学生用书?第17页
选项 粒子组 判断和分析
A Na+、Al3+、Cl-、NH3·H2O 不能大量共存,因发生反应:Al3++4NH3·H2O===AlO+4NH+2H2O
B H+、K+、S2O、SO 不能大量共存,因发生反应:2H++S2O===S↓+SO2↑+H2O
C Na+、Fe3+、SO、H2O2 能大量共存,粒子间不反应
D H+、Na+、Cl-、MnO 能大量共存,粒子间不反应
B [Al3+和NH3·H2O生成Al(OH)3沉淀而不是生成AlO,故A错误;S2O和H+反应生成单质硫、二氧化硫和水,离子方程式为:2H++S2O===S↓+SO2↑+H2O,故B正确;Fe3+可以将H2O2氧化得到Fe2+和O2,不能大量共存,故C错误;在酸性条件下MnO能将Cl-氧化为Cl2,不能大量共存,故D错误。]
4.(2020·江苏高考,4)常温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1氨水溶液:Na+、K+、OH-、NO
B.0.1 mol·L-1盐酸溶液:Na+、K+、SO、SiO
C.0.1 mol·L-1KMnO4溶液:NH、Na+、NO、I-
D.0.1 mol·L-1AgNO3溶液:NH、Mg2+、Cl-、SO
A [在0.1 mol/L氨水中,四种离子可以大量共存,A符合题意;在0.1 mol/L盐酸中含有大量氢离子,四种离子中硅酸根离子可以与氢离子反应生成硅酸沉淀,故不能共存,B不符合题意;MnO具有强氧化性,可以将碘离子氧化成碘单质,故不能共存,C不符合题意;在0.1 mol/L硝酸银溶液中,银离子可以与氯离子、硫酸根离子反应生成氯化银、硫酸银沉淀,不能共存,D不符合题意。]
5.[2021·广东高考,17(3)]某氯水久置后不能使品红溶液褪色,可推测氯水中 已分解。检验此久置氯水中Cl-存在的操作及现象是
。
答案: HClO 取少量样品于试管中,加入稀硝酸,再滴加AgNO3溶液,若有白色沉淀生成,则证明样品中含有Cl-
课时精练(三) 离子反应的应用
(本栏目内容,在学生用书中以独立形式分册装订!)
1.(2022·重庆二模)下列各组离子能大量共存的是( )
A.Fe3+、Na+、SCN-、SO
B.K+、Na+、ClO-、I-
C.Al3+、Ca2+、HCO、NO
D.NH、Cu2+、CH3COO-、NO
D [铁离子和SCN-反应生成络合离子,不能大量共存,A错误;ClO-、I-两者会发生氧化还原反应,不能大量共存,B错误;铝离子和碳酸氢根离子会发生双水解,两者不能大量共存,C错误;四种离子相互之间不反应,能大量共存,D正确。]
2.(2022·上海宝山二模)下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A.H+、NO、Fe2+、Na+
B.Ag+、NO、Cl-、K+
C.K+、Ba2+、OH-、SO
D.Cu2+、NH、Br-、OH-
A [存在氢离子,则酸性环境下Fe2+被NO氧化为Fe3+不能共存,A选;Ag+与Cl-生成氯化银沉淀不共存,不是氧化还原反应,B不选;Ba2+与SO生成硫酸钡沉淀不共存,不是氧化还原反应,C不选;Cu2+、NH能分别与OH-生成氢氧化铜沉淀和NH3·H2O不共存,不是氧化还原反应,D不选。]
3.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1溶液中:HCO、K+、Cl-、Fe3+
B.无色溶液中:NH、K+、MnO、NO
C.含SO的溶液中:NO、OH-、Na+、Ba2+
D.c(OH-)=10-2 mol/L溶液中:Na+、CO、Cl-、K+
D [pH=1的溶液是强酸性溶液,HCO不能大量共存,A不符合题意;MnO是紫红色溶液,B不符合题意;SO与Ba2+生成沉淀不能大量共存,C不符合题意;c(OH-)=
10-2 mol/L溶液是碱性溶液,Na+、CO、Cl-、K+能大量共存,D符合题意。]
4.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色透明溶液中:K+、Na+、NO、SO
B.0.1 mol·L-1 KI溶液:Na+、Ca2+、ClO-、OH-
C.0.1 mol·L-1 HCl溶液:Ba2+、K+、CH3COO-、NO
D.使pH试纸显蓝色的溶液中:Cu2+、Fe3+、NO、SO
A [无色透明溶液中这几种离子均不发生反应,一定能大量共存,故A正确;I-具有还原性,ClO-具有氧化性,能发生氧化还原反应,一定不能大量共存,故B错误;酸性环境下CH3COO-会生成醋酸弱电解质,一定不能大量共存,故C错误;使pH试纸显蓝色的溶液显碱性,有大量OH-, OH-与Cu2+、Fe3+生成沉淀,一定不能大量共存,故D错误。]
5.(2022·天津模拟)常温下,下列各组离子在指定溶液中可能大量共存的是( )
A.麦芽糖溶液中:MnO、K+、H+、SO
B.含有大量Fe3+的溶液中:Al3+、CO、NH、Br-
C.pH=0的溶液中:K+、Na+、SO、S2O
D.水电离出来的c(H+)=10-13 mol/L的溶液:K+、CO、Br-、AlO
D [麦芽糖具有还原性,会和酸性高锰酸钾反应,不能大量共存,A错误;铁离子、铝离子会和碳酸根离子发生双水解反应,不能共存,B错误;pH=0的溶液为强酸性溶液,S2O会和氢离子反应生成硫单质和二氧化硫,不能共存,C错误;水电离出来的c(H+)=10-13 mol/L的溶液,可能为碱性溶液,在碱性溶液中,该四种离子均能存在且相互不反应,可能共存,D正确。]
6.某白色固体混合物由NaCl、KCl、MgSO4、CaCO3中的两种组成,进行如下实验:①混合物溶于水,得到澄清透明溶液;②做焰色试验,通过蓝色钴玻璃可观察到紫色;③向溶液中加碱,产生白色沉淀。根据实验现象可判断其组成为( )
A.KCl、NaCl B.KCl、MgSO4
C.KCl、CaCO3 D.MgSO4、NaCl
B [①混合物溶于水,得到澄清透明溶液,则不含CaCO3;②做焰色试验,通过蓝色钴玻璃可观察到紫色,可确定含有钾元素,即含有KCl;③向溶液中加碱,产生白色沉淀,则应含有MgSO4,综合以上分析,混合物由KCl和MgSO4两种物质组成。]
7.(2022·湖南省百所学校高三联考)下列各组粒子在溶液中可以大量共存,且在加入试剂X后发生反应的离子方程式书写也正确的是( )
选项 微粒组 试剂X 发生反应的离子方程式
A Cl-、NO、Al3+、NH 少量NaHCO3溶液 Al3++3HCO===3CO2↑+Al(OH)3↓
B NH、Fe2+、I-、SO 少量氯水 2Fe2++Cl2===2Fe3++2Cl-
C Al3+、Ba2+、AlO、NO 适量的Na2SO4 Ba2++SO===BaSO4↓
D Na+、SO、S2-、Cl- 适量HCl SO+S2-+4H+===2S↓+2H2O
A [Al3+和HCO发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,故为Al3++3HCO===3CO2↑+Al(OH)3↓,A项正确;I-的还原性大于Fe2+的还原性,加入少量氯水的时候,离子方程式为2I-+Cl2===I2+2Cl-,B项错误;Al3+与AlO会发生双水解生成Al(OH)3,C项错误;亚硫酸根离子和硫离子在酸性条件下发生氧化还原反应生成单质S,故加入适量HCl的离子方程式为SO+2S2-+6H+===3S↓+3H2O,D项错误。]
8.(2022·湖南模拟预测)某盐M由两种阳离子和一种阴离子构成,为了确定M的组成,进行如图实验:
下列说法正确的是( )
A.加入NaOH溶液的离子反应为NH+OH-NH3↑+H2O
B.上述白色沉淀是BaSO4
C.加入氯水发生的离子反应为Fe2++Cl2===2Cl-+Fe3+
D.M可能是NH4Fe(SO4)2
B [由题干实验图示信息可知,实验中加入KSCN溶液,无明显现象,加入氯水后,溶液变红色,说明原溶液中含有Fe2+,实验中加入浓NaOH溶液加热后产生能使湿润的红色石蕊试纸变蓝的气体,说明原溶液中含有NH,实验中先加入足量的稀盐酸,无明显现象,加入足量的BaCl2溶液产生白色沉淀,说明原溶液中含有SO,由此分析可知,某盐M的组成为(NH4)2Fe(SO4)2,据此分析解题。由分析可知,原溶液中含有Fe2+和NH,故加入NaOH溶液的离子反应为Fe2++NH+3OH-NH3↑+H2O+Fe(OH)2↓,A错误;由分析可知,上述白色沉淀是BaSO4,B正确;加入氯水发生的离子反应为2Fe2++Cl2===
2Cl-+2Fe3+,选项中离子方程式电荷不守恒,C错误;由分析可知,原溶液中含有Fe2+、不含Fe3+,则M不可能是NH4Fe(SO4)2,M的组成为(NH4)2 Fe(SO4)2,D错误。]
9.现有S2-、SO、NH、Al3+、HPO、Na+、SO、AlO、Fe3+、HCO、Cl-,请按要求填空:
(1)在水溶液中,水解后溶液呈碱性的离子是
。
(2)在水溶液中,水解后溶液呈酸性的离子是 _
。
(3)既能在酸性较强的溶液中大量存在,又能在碱性较强的溶液中大量存在的离子有
。
(4)既不能在酸性较强的溶液中大量存在,又不能在碱性较强的溶液中大量存在的离子有
。
解析: (1)弱酸根离子水解后溶液呈碱性,部分酸式酸根离子的水解程度大于电离程度,其水溶液也呈碱性,故填S2-、SO、HPO、AlO、HCO。(2)NH、Al3+、Fe3+属于弱碱阳离子,水解后溶液呈酸性。(3)Na+是强碱的阳离子,Cl-和SO是强酸的阴离子,它们既能在强酸性溶液中存在,又能在强碱性溶液中存在。(4)HPO、HCO既能与强酸反应,又能与强碱反应。
答案: (1)S2-、SO、HPO、AlO、HCO (2)NH、Al3+、Fe3+ (3)Na+、Cl-、SO (4)HPO、HCO
10.某工业废水中仅含表中离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol/L。
阳离子 K+、Mg2+、Fe3+、Al3+、Fe2+
阴离子 Cl-、CO、NO、SO、SiO
某同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色;此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由①、②、③判断,溶液中一定不含有的阴离子是 ,一定不含有的阳离子是 (写离子符号)。
(2)③中加入少量盐酸生成无色气体的离子方程式是 _,
④中生成白色沉淀的离子方程式是 _
。
(3)该同学最终确定原溶液中所含阴离子是 ,阳离子是 (写离子符号)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g。
解析: (1)由①、②、③判断,溶液中一定不含有的阳离子是K+、Fe3+,一定不含有的阴离子是CO和SiO。(2)③中加入少量盐酸生成无色气体的的离子方程式是3Fe2++NO+4H+===3Fe3++NO↑+2H2O;④中生成白色沉淀的离子方程式是Ba2++SO===BaSO4↓。(3)根据工业废水中仅含表中离子中的5种,最终确定原溶液中所含的阴离子是Cl-、NO、SO,阳离子是Fe2+、Mg2+。(4)原溶液中所含阳离子是Fe2+、Mg2+,若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体是MgO, Fe2O3,根据题意知各离子的物质的量均为0.01 mol,所以m(MgO)=0.01 mol×40 g/mol=0.4 g, m(Fe2O3)=0.005 mol×160 g/mol=0.8 g,所得固体的质量为0.4 g+0.8 g=1.2 g。
答案: (1)CO、SiO K+、Fe3+
(2)3Fe2++NO+4H+===3Fe3++NO↑+2H2O Ba2++SO===BaSO4↓
(3)Cl-、NO、SO Fe2+、Mg2+ (4)1.2
11.现有四种溶液m、n、p、q,分别含阴阳离子NH、Na+、Ba2+、Al3+、OH-、SO、HCO、NO中的各一种,为了确定组成,进行了以下实验:将四种溶液两两混合,发现m、n能剧烈反应,产生白色沉淀和无色气体,p、q能产生无色有刺激性气味的气体,p与m、n均有沉淀产生,且在m中逐滴滴入p时,沉淀增多,后减少但没有完全消失。回答下列问题。
(1)p是 ,q是 (均填化学式)。
(2)写出在m中逐滴滴入p,沉淀减少时发生反应的离子方程式: 。
(3)实验室检验q中阳离子需要的试剂和试纸是 。
(4)经分析,SO存在于 (填m、n、p、q)溶液中,实验室常用重量法检验该溶液中SO的浓度,步骤如下:Ⅰ.用量筒取该溶液8.0 mL并转移至小烧杯中;Ⅱ.加入盐酸酸化,然后加入足量的BaCl2溶液(沉淀反应在接近沸腾的温度下进行);Ⅲ.过滤所得沉淀,洗涤,烘干后得到a g固体。
①所用量筒的规格为 。
A.10 mL B.50 mL
C.100 mL D.500 mL
②过滤时,沉淀物颗粒的大小会影响过滤速度,从利于过滤的角度分析,沉淀反应需要在接近沸腾的温度下进行的原因可能是
。
③检验沉淀洗涤干净的方法是 _
。
④计算,硫酸根的浓度为 mol/L(用含a的式子表示)。
解析: 由在m中逐滴滴入p时,沉淀增多,后减少但没有完全消失可知,在现有离子中,能满足先产生沉淀后沉淀部分溶解现象的,一定是向铝盐溶液中逐滴滴入强碱溶液,故m为可溶性铝盐,p为强碱,再结合碱过量,沉淀未完全溶解,说明强碱与铝盐混合,除了有氢氧化铝生成,还有其他沉淀生成,则可判断出m为Al2(SO4)3,p为Ba(OH)2,p、q能产生无色有刺激性气味的气体,q含NH,m、n能剧烈反应,产生白色沉淀和无色气体,符合铝离子与HCO双水解生成氢氧化铝和二氧化碳的现象,则n含HCO,由于所剩离子仅为Na+和NO,溶液呈电中性,故q为NH4NO3,n为NaHCO3。
(1)根据上述分析,p为Ba(OH)2,q为NH4NO3。
(2)m为Al2(SO4)3,p为Ba(OH)2,沉淀为氢氧化铝,沉淀减少时的离子方程式为Al(OH)3+OH-===AlO+2H2O。
(3)q为NH4NO3,则检验NH的方法为:取待测液于试管中,加入浓氢氧化钠溶液,加热,用湿润的红色石蕊试纸检验逸出的气体,若试纸变蓝,则原待测液中含NH,故需要的试剂和试纸为浓氢氧化钠溶液和湿润的红色石蕊试纸。
(4)m为Al2(SO4)3,故SO存在于m溶液中。①量筒量取液体时,所选规格遵循“近而大”的原则,故选规格为10 mL的量筒。②过滤时,沉淀物颗粒的大小会影响过滤速度,颗粒较大,有利于液体顺利滤出,故沉淀过程在接近沸腾的温度下进行,是为了使沉淀尽量凝聚,即有利于产生颗粒较大的沉淀。③检验沉淀是否洗涤干净,本质就是沉淀表面是否仍有可溶性离子残留,即是否有Cl-残留。④烘干后的固体成分仍为BaSO4,硫元素守恒,故8.0 mL溶液中,n(SO)=n(BaSO4)= mol,则c(SO)== mol/L。
答案: (1)Ba(OH)2 NH4NO3 (2)Al(OH)3+OH-===AlO+2H2O (3)浓NaOH溶液、湿润的红色石蕊试纸 (4)m ①A ②沸腾时,有利于产生颗粒较大的沉淀 ③用小试管取最后一次洗涤液少许,向其中加入少量的AgNO3溶液,如没有出现浑浊,说明沉淀洗涤干净,反之,说明沉淀没有洗涤干净 ④
图片资源预览