8.3《金属资源的利用和保护》巩固提升练(含解析)人教版初中化学九年级下册
2023-11-04 19:31:39 学考宝 作者:佚名
Word文档版
学考宝(xuekaobao.com)友情提示:html格式不完整,如有需要请根据文末提示下载并进行二次校对Word文档。
8.3《金属资源的利用和保护》巩固提升练-人教版初中化学九年级下册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.对下列事实或做法的解释正确的是
A.用明矾净水——明矾可降低水中钙、镁离子的含量
B.铁质水龙头表面镀铬可防锈——改变了金属的内部结构
C.众人拾柴火焰高——可燃物越多,着火点越低,越易燃烧
D.氧气能被液化贮存于钢瓶——分子间有间隔
2.铁是一种应用广泛的金属。下列叙述错误的是
A.铁是地壳中含量第二多的金属 B.炼铁高炉中CO的生成属于化合反应
C.炼铁时CO与Fe2O3发生置换反应 D.用铁可以回收硝酸银废液中的银
3.现有:①生铁,②赤铁矿,③氧气,④空气,⑤石灰石,⑥生石灰,⑦无烟煤,⑧焦炭。炼铁高炉中投放的基本原料是以上物质中的哪几种
A.①③⑤⑦ B.②④⑥⑧ C.②④⑤⑧ D.①③⑥⑦
4.化学就在我们身边,下列厨房中的变化,属于物理变化的是
A.煤气燃烧 B.食物腐烂
C.冲洗蔬菜 D.铁锅生锈
5.下列有关资源和能源的说法正确的是
A.空气是一种宝贵的资源,其中含量最多的是氧气
B.为了节约化石能源,要大力开发太阳能、核能、水能等新能源
C.回收废旧金属既节约金属资源又减少对环境的污染
D.将煤隔绝空气加强热会得到煤焦油、煤油、煤气等产品
6.下列关于金属有关的说法正确的是
A.生铁和钢都是铁的合金
B.银的导电性比铜强,所以一般用银作导线
C.铁矿石在地壳中含量最丰富,可以随意开采
D.铝不易被腐蚀,是因为铝的活泼性差
7.我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭混合加热至800℃,得到一种外形似金子的锌铜合金(俗称黄铜)。下列说法正确的是
A.Cu2O中铜的化合价为+2价 B.黄铜熔点比铜与锌的熔点都低
C.该变化过程中有化合反应 D.通过观察颜色可鉴别金子与黄铜
8.下列有关金属的说法错误的是
A.铝具有很好的抗腐蚀性
B.黄铜的硬度比纯铜的硬度大
C.日常生活中,钢铁表面刷油漆可以防止生锈
D.地球上的金属资源金、银、铜、铁都有单质形式存在
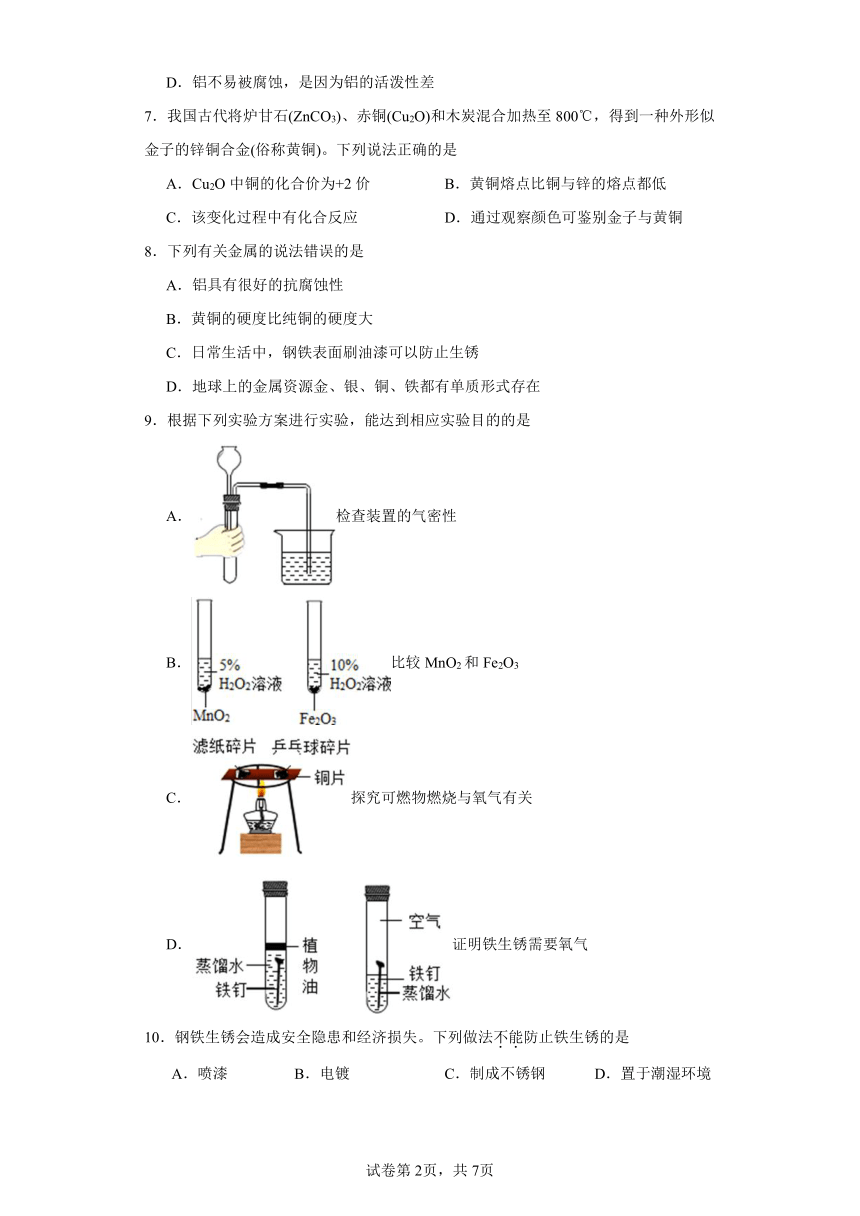
9.根据下列实验方案进行实验,能达到相应实验目的的是
A.检查装置的气密性
B.比较MnO2和Fe2O3
C.探究可燃物燃烧与氧气有关
D.证明铁生锈需要氧气
10.钢铁生锈会造成安全隐患和经济损失。下列做法不能防止铁生锈的是
A.喷漆 B.电镀 C.制成不锈钢 D.置于潮湿环境
二、判断题
11.目前世界上已有90%以上的铁和50%以上的金得到了回收利用( )
12.铁生锈是铁与空气中的氧气、水蒸气等发生化学反应的过程( )
13.铁粉容易生锈,可用作食品脱氧剂( )
14.防止金属腐蚀、寻找金属替代品都是保护金属资源的有效途径。( )
15.铁生锈需要铁和空气中二氧化碳、水共同作用( )
三、填空题
16.新能源汽车离不开金属材料和新能源。
(1)下列能源不属于新能源的是 (填序号);
A 氢能 B 核能 C 石油 D 风能
(2)锂电池可为新能源汽车提供动力,由 能转化为机械能;
(3)新能源汽车使用的硬铝和纯铝相比,硬度较大的是 ;
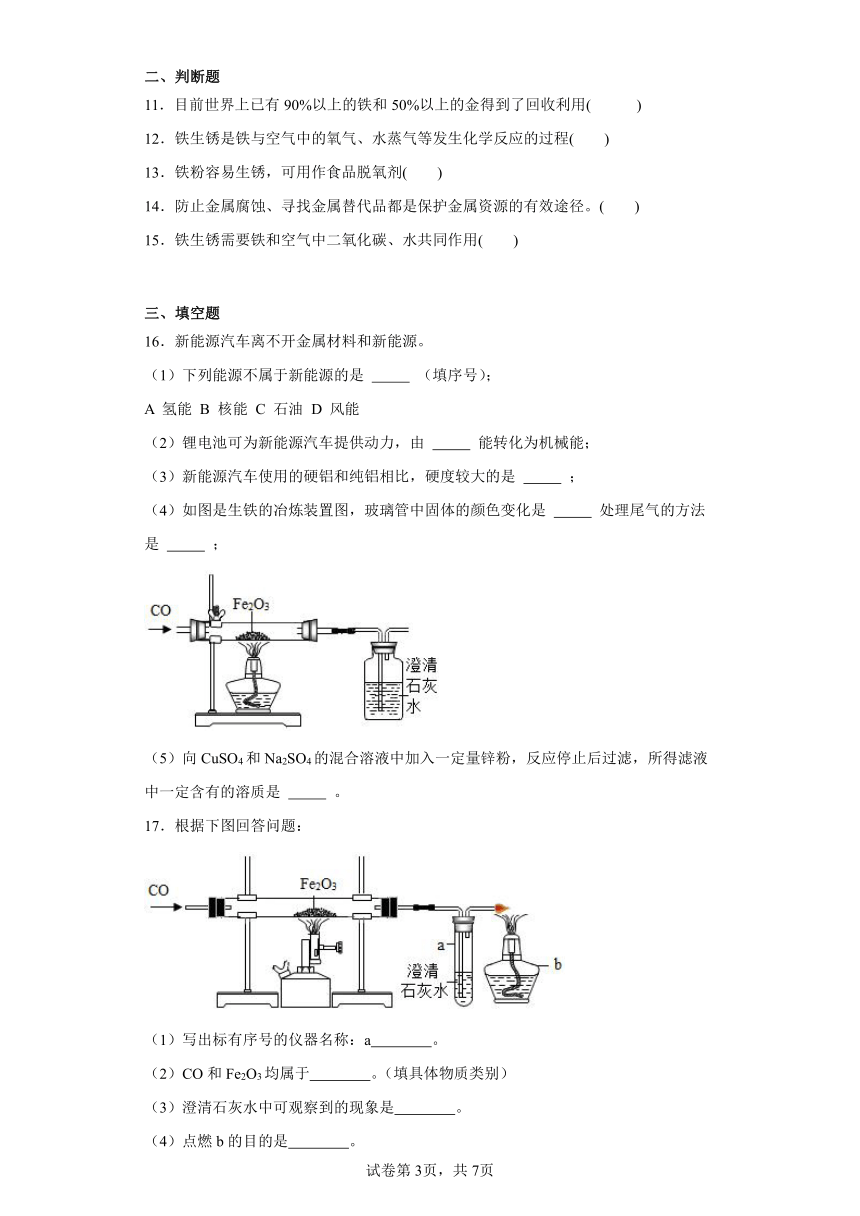
(4)如图是生铁的冶炼装置图,玻璃管中固体的颜色变化是 处理尾气的方法是 ;
(5)向CuSO4和Na2SO4的混合溶液中加入一定量锌粉,反应停止后过滤,所得滤液中一定含有的溶质是 。
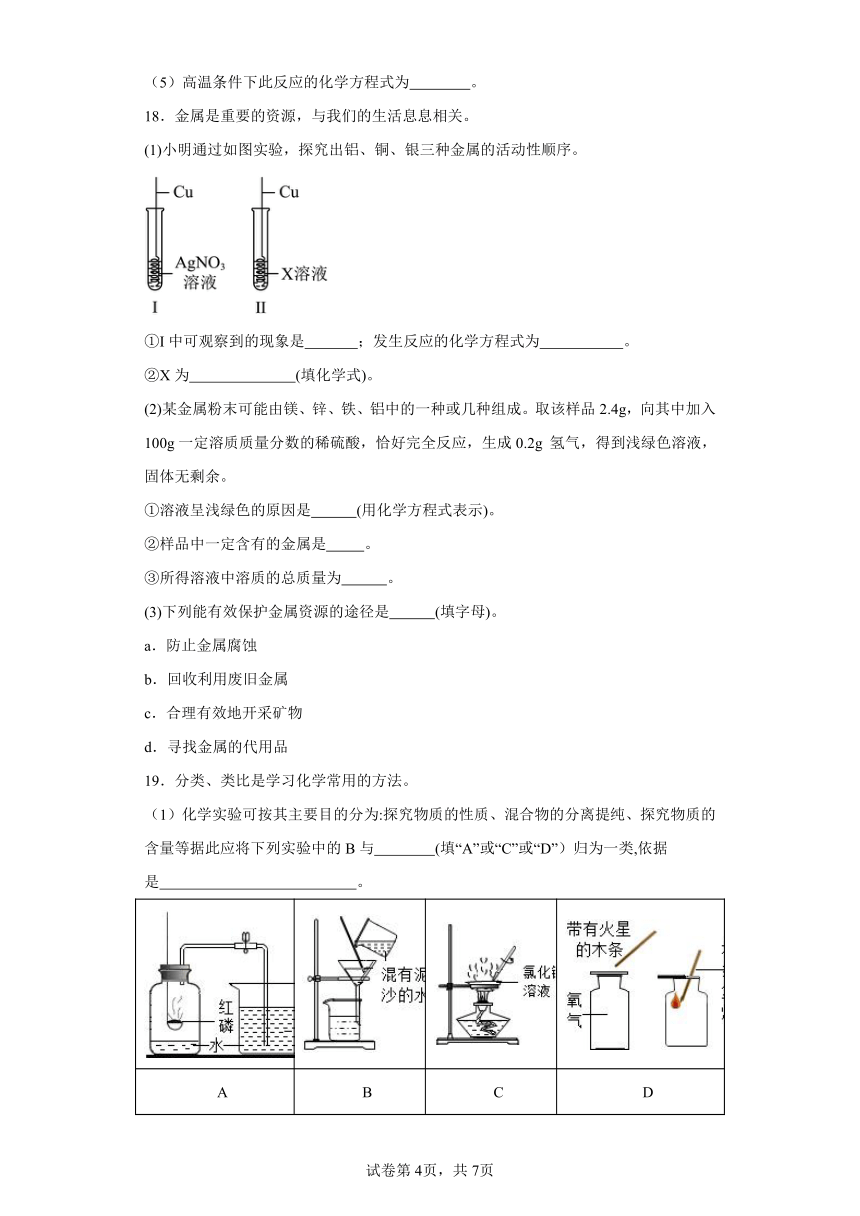
17.根据下图回答问题:
(1)写出标有序号的仪器名称:a 。
(2)CO和Fe2O3均属于 。(填具体物质类别)
(3)澄清石灰水中可观察到的现象是 。
(4)点燃b的目的是 。
(5)高温条件下此反应的化学方程式为 。
18.金属是重要的资源,与我们的生活息息相关。
(1)小明通过如图实验,探究出铝、铜、银三种金属的活动性顺序。
①I中可观察到的现象是 ;发生反应的化学方程式为 。
②X为 (填化学式)。
(2)某金属粉末可能由镁、锌、铁、铝中的一种或几种组成。取该样品2.4g,向其中加入100g一定溶质质量分数的稀硫酸,恰好完全反应,生成0.2g 氢气,得到浅绿色溶液,固体无剩余。
①溶液呈浅绿色的原因是 (用化学方程式表示)。
②样品中一定含有的金属是 。
③所得溶液中溶质的总质量为 。
(3)下列能有效保护金属资源的途径是 (填字母)。
a.防止金属腐蚀
b.回收利用废旧金属
c.合理有效地开采矿物
d.寻找金属的代用品
19.分类、类比是学习化学常用的方法。
(1)化学实验可按其主要目的分为:探究物质的性质、混合物的分离提纯、探究物质的含量等据此应将下列实验中的B与 (填“A”或“C”或“D”)归为一类,依据是 。
A B C D
(2)在反应C + CO22CO中,具有氧化性的反应物是 。请写出一个两种化合物发生反应的化学方程式(其中一种化合物体现氧化性,另一种化合物体 现还原性)
20.燃烧是人类最早利用的化学反应。
(1)为了使煤燃烧更充分,往往将大块的煤粉碎,这样做的目的是什么?
(2)燃烧的蜡烛可以用嘴吹灭,其原现是什么?
(3)工业上用于炼铁的矿石是赤铁矿,炼铁过程中焦炭的作用是什么是什么?
四、综合应用题
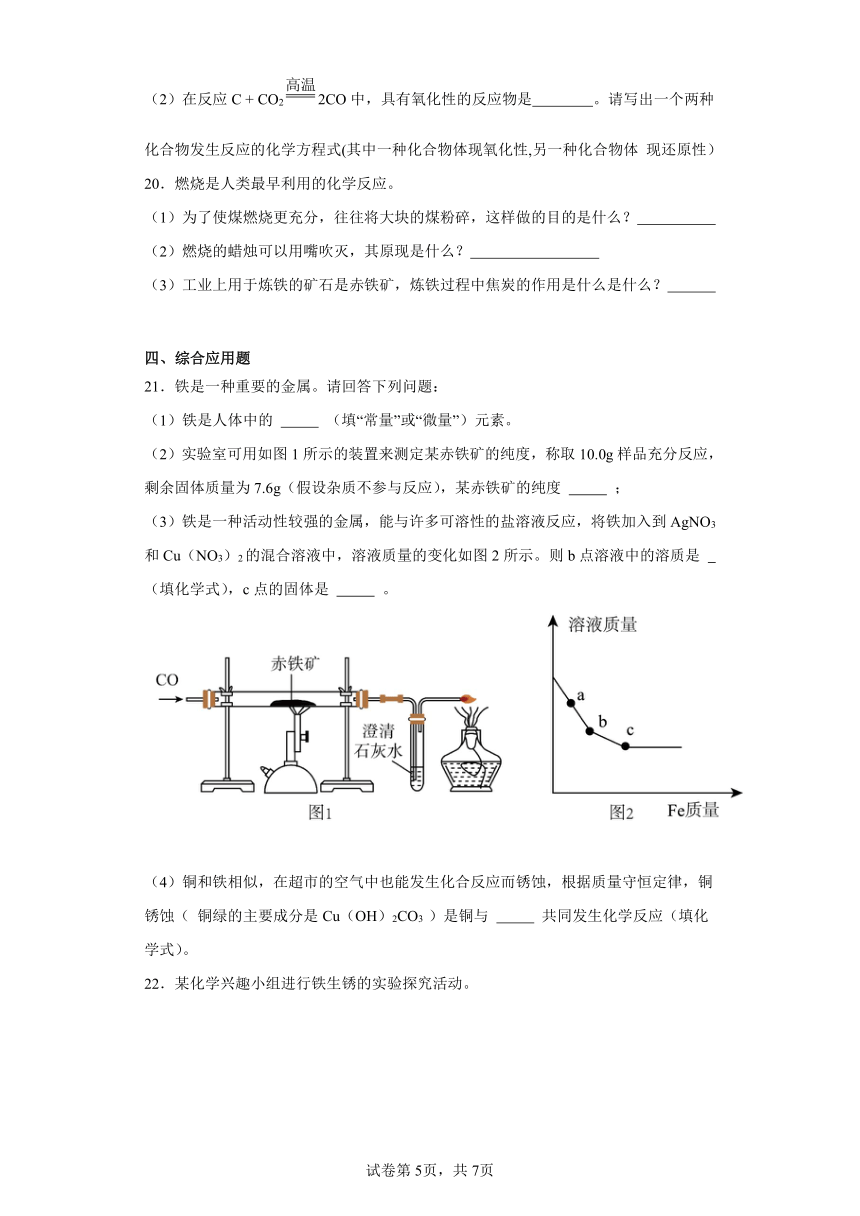
21.铁是一种重要的金属。请回答下列问题:
(1)铁是人体中的 (填“常量”或“微量”)元素。
(2)实验室可用如图1所示的装置来测定某赤铁矿的纯度,称取10.0g样品充分反应,剩余固体质量为7.6g(假设杂质不参与反应),某赤铁矿的纯度 ;
(3)铁是一种活动性较强的金属,能与许多可溶性的盐溶液反应,将铁加入到AgNO3和Cu(NO3)2的混合溶液中,溶液质量的变化如图2所示。则b点溶液中的溶质是 (填化学式),c点的固体是 。
(4)铜和铁相似,在超市的空气中也能发生化合反应而锈蚀,根据质量守恒定律,铜锈蚀( 铜绿的主要成分是Cu(OH)2CO3 )是铜与 共同发生化学反应(填化学式)。
22.某化学兴趣小组进行铁生锈的实验探究活动。
(1)该兴趣小组将洁净无锈的铁钉分别置于如图所示装置中,经过一段时间观察, (填装置序号)装置中出现了明显的锈迹。他们的结论:铁生锈是因为铁与空气中的 等发生了化学反应。
(2)甲同学提出了疑问:空气中的氮气、二氧化碳没有参与铁的生锈过程吗?请设计实验为甲同学释疑。 ,观察并记录现象即可证明。
(3)一些铁制品表面覆盖了某些涂层,不同的涂层被破坏后,铁生锈的速率不同。你认为下列 涂层破坏后,铁生锈的速率较快。
a.镀锌铁 b.镀锡铁
(4)一些建筑的大门刷上了一层银白色的金属,你认为该金属可能是 。
a.银粉 b.铜粉 c.镁粉
【交流与思考】(5)写出一种防止铁生锈的方法 。
23.习近平总书记提出要文化自信,作为有五千年历史的中华文明的一分子,你对我国各时期的贡献了解吗。
(1)四大发明:享誉世界的四大发明是我们的骄傲
a指南针:是用铁在高温下打制成针状,并依靠表面的四氧化三铁的特性来工作的,请写出制作过程发生的反应方程式 。
b造纸术:解决了如何普及教育,让知识大面积推广的问题,实验室使用的滤纸也是一种特殊的纸,那么过滤操作对混合物有什么作用 。
c火药:无需空气就可以快速燃烧的物质,是利用碳、硫、硝酸钾混合而成,点燃后生成硫化钾、和另外两种空气中常见气体,请完成该反应方程式 。
d活字印刷术:是毕昇发明的,它是将黏土制成字模在用火烧制而成。
(2)文房四宝:是我们文明等级远高于同时期其他文明的例证
A湖笔:作为四宝之首选用竹杆、狼毫制成,请设计实验证明笔尖不是化纤制品 。
B徽墨:徽墨的制作往往需要砍伐许多树枝,点燃后关于窑中,收集窑壁上的碳加入其他成分制作而成,实质是树枝发生了 而形成的。
C宣纸:造纸过程中会将植物的茎浸泡在水中,加入生石灰、草木灰、纯碱,写出其中发生的两个不同类型的反应 , 。
D端砚:是采用天然石料打磨而成质地细腻,如何证明石料不是石灰石 。
(3)进入新世纪以来,我国科技发展日新月异,国力的日益强大印证了科技兴则民族兴、科技强则民族强的道理。5月30日神州十六号成功发射,我们再一次见证了中国科技的飞速发展
① 神州十六号飞船的表面都喷有一层油漆,目的是为防止探测器表面的金属生锈,其防锈原理为隔绝 和 。
② 神州十六飞船的太阳能电池板和电脑芯片中,硅是不可缺少的材料。人们利用石英砂(主要成分是二氧化硅SiO2)制得高纯硅。其制取原理包含:SiO2+2CSi+2 ↑,该反应类型为 反应(填“分解”、“化合”、“置换”或“复分解”)。
③在神州十六号飞船的控制系统中也使用了导电性优良的金属铜。铜可采用如下方法制备:
方法一:火法炼铜:Cu2S+O2Cu+SO2
方法二:湿法炼铜:Fe+CuSO4=Cu+FeSO4
两种方法中,你认为方法 (填“一”或“二”)更好,原因是 (一点即可)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A、明矾溶于水形成胶状物,会吸附不溶性杂质、沉降以达到净水目的,故A错误;
B、在铁制品表面镀层,没有改变金属的内部结构,故错误;
C、着火点是物质的固有属性,一般情况下不发生改变,故错误;
D、分子之间有间隔,可将6000L的氧气压缩在40L的钢瓶中,故正确。
故选D
2.C
【详解】A、地壳中元素含量由多到少的顺序前五位为氧、硅、铝、铁、钙,铁是地壳中含量第二多的金属元素,不符合题意;
B、炼铁高炉中CO是二氧化碳与碳在高温下反应生成,该反应符合“多变一”的特点,属于化合反应,不符合题意;
C、炼铁时,一氧化碳与氧化铁在高温下反应生成铁和二氧化碳,该反应的反应物是两种化合物,不属于置换反应,符合题意;
D、铁能与硝酸银反应生成硝酸亚铁和银,用铁可以回收硝酸银废液中的银,不符合题意。
故选C。
3.C
【详解】根据工业炼铁的原理可知,炼铁的原料中一定有赤铁矿,由此可排除A和D选项,在工业炼铁中需要用到石灰石将赤铁矿中的二氧化硅等杂质转化成炉渣除去,所以炼铁的原料中需要的是石灰石而不是生石灰,由此可以排出B。故选C。
4.C
【详解】A.煤气燃烧有新物质生成,属于化学变化;
B.食物腐烂有新物质生成,属于化学变化;
C.冲洗蔬菜,没有新物质生成,属于物理变化;
D.铁锅生锈有新物质生成,属于化学变化。
故选:C。
5.C
【详解】A、空气中含量最多的是氮气,错误;
B、水能是人们早已经开发的能源,不是新能源,错误;
C、回收废旧金属既节约金属资源又减少对环境的污染,正确;
D、煤油是石油的分馏产品,不是煤的干馏产品,错误。故选C。
6.A
【详解】A、生铁和钢都是铁的合金,正确;
B、银的导电性比铜强,但是银的价格高,故一般不用银作导线,错误;
C、铁矿石在地壳中含量最丰富,但是可供开采利用的年代不长,不可以随意开采,错误;
D、铝不易被腐蚀,是因为铝易被氧气氧化生成一层致密的氧化铝保护膜,起到了保护的作用,错误。
故选A。
7.B
【详解】A、氧化亚铜中氧元素的化合价是-2价, 设铜元素是化合价为x,根据化合价的代数和为0,2x+(-2)=0,得x=+1价,故错误;
B、黄铜是铜和锌的合金,合金的熔点比组成纯金属的熔点低,故黄铜熔点比铜与锌的熔点都低,故正确;
C、炉甘石(ZnCO3)、赤铜(Cu2O)和木炭混合加热至800℃,可能发生的反应有碳酸锌分解生成氧化锌和二氧化碳,碳与氧化锌反应生成锌和二氧化碳,碳与氧化亚铜反应生成铜和二氧化碳,碳与二氧化碳的反应温度需要达到1000℃,故碳不与二氧化碳反应,故反应中没有化合反应,故错误;
D、黄铜与金子的外观颜色非常相似,故不能通过观察颜色鉴别金子与黄铜,故错误。故选B。
8.D
【详解】A、铝在空气中能与氧气反应,其表面生成一层致密的氧化铝薄膜,防止内部的铝进一步被氧化,因此铝制品抗腐蚀性强,故选项说法正确;
B、合金的硬度比组成它的纯金属的硬度大,黄铜的硬度比纯铜的硬度大,故选项说法正确;
C、日常生活中,钢铁表面刷油漆,能隔绝氧气和水,可以防止生锈,故选项说法正确;
D、地球上的金属资源广泛地存在于地壳和浩瀚的海洋中,除少数很不活泼的金属(如金、银等)以单质形式存在外,其余的都以化合物的形式存在,没有以单质形式存在的铁,故选项说法错误。
故选D。
9.D
【详解】A、试管处长颈漏斗与外界相通,如图检验不能观察到导管口气泡冒出,不能达到实验目的;
B、两只试管中催化剂种类和过氧化氢的浓度不同,有两组变量,不符合探究实验的控制变量法,不能达到实验目的;
C、滤纸碎片和乒乓球碎片都是可燃物、都与氧气充分接触,不同点是二者着火点不同,所以该实验是探究可燃物燃烧与温度有关,不能达到实验目的;
D、左边试管中用植物油起到密封的作用,铁钉与氧气隔绝;右边试管的铁钉与空气充分接触,可以证明铁生锈需要氧气,能达到实验目的;
故选D
10.D
【详解】A、喷漆能隔绝氧气和水,从而防止铁生锈,该选项不符合题意;
B、电镀能防止铁生锈,该选项不符合题意;
C、将铁制成不锈钢,能防止铁生锈,该选项不符合题意;
D、铁与氧气和水共同接触时会生锈,将铁置于潮湿环境中,不能防止铁生锈,该选项符合题意。
故选D。
11.错误
【详解】目前世界上已有50%以上的铁的90%以上的金得到了回收利用,题目说法错误。
12.正确
【详解】铁生锈是铁与空气中的氧气、水蒸气等发生化学反应的过程,正确。
13.正确
【详解】铁生锈是铁与氧气、水发生的化学反应,故可用作食品脱氧剂,正确。
14.正确
【详解】保护金属资源的有效途径包括:防止金属腐蚀、寻找金属替代品,故正确。
15.错误
【详解】铁生锈需要铁和空气中氧气、水共同作用,错误。
16. C 化学 硬铝 红色粉末变黑色 在装置的末端放一盏燃着的酒精灯燃烧尾气 硫酸钠、硫酸锌
【详解】(1)人们正在利用和开发的新能源有氢能、太阳能、核能、风能、地热能、潮汐能、生物质能等;石油属于化石燃料,不属于新能源;故填:C;
(2)锂电池可为新能源汽车提供动力,是由化学能转化为机械能;故填:化学;
(3)硬铝属于铝合金,金属制成合金后硬度变大,与纯铝相比,硬铝的硬度更大,故填:硬铝;
(4)在高温的条件下,一氧化碳与氧化铁反应生成铁和二氧化碳,所以硬质玻璃管内固体由红色变成黑色;尾气中含有有毒的一氧化碳,为了防止尾气排放到空气中造成污染,需要在装置的末端放一盏燃着的酒精灯将其燃烧掉;故填:红色粉末变黑色; 在装置的末端放一盏燃着的酒精灯燃烧尾气;
(5)钠的金属活动性比锌强,锌的金属活动性比铜强,所以向CuSO4和Na2SO4的混合溶液中加入一定量锌粉,锌与硫酸钠不反应,能与硫酸铜反应生成铜和硫酸锌。所以所得滤液中一定含有的溶质是没参加反应的硫酸钠及生成的硫酸锌;故填:硫酸钠、硫酸锌。
17. 试管 氧化物 澄清石灰水变浑浊 除去尾气中的一氧化碳,防止污染空气
【详解】(1)仪器a是试管。
(2)氧化物是由两种元素组成的化合物,其中一种元素是氧元素。CO和Fe2O3均属于氧化物。
(3)一氧化碳可与氧化铁反应生成二氧化碳,二氧化碳能能与氢氧化钙反应生成碳酸钙沉淀和水,所以澄清石灰水中可观察到的现象是澄清石灰水变浑浊。
(4)点燃b的目的是除去尾气中的一氧化碳,防止污染空气。
(5)一氧化碳可与氧化铁反应生成二氧化碳和铁,高温条件下此反应的化学方程式为
18. 红色固体表面析出银白色固体,溶液颜色由无色变为蓝色 Cu + 2AgNO3 = Cu(NO3)2 +2Ag Al(NO3)3(合理即可) Fe + H2SO4 = FeSO4 + H2↑ Fe和Al 12g abcd
【详解】(1)①铜与硝酸银反应生成硝酸铜和银,可观察到红色固体表面析出银白色固体,溶液颜色由无色变为蓝色,反应的化学方程式为Cu + 2AgNO3 = Cu(NO3)2 +2Ag,故填:红色固体表面析出银白色固体,溶液颜色由无色变为蓝色;Cu + 2AgNO3 = Cu(NO3)2 +2Ag;
②试管I的实验现象可以说明铜的活动性比银强;为了达到实验目的,试管Ⅱ的溶液X为硝酸铝溶液,将铜插入到硝酸铝溶液中,无明显现象,说明铝的活动性比铜强,即可比较得出铝、铜、银三种金属的活动性顺序为铝>铜>银,故填:Al(NO3)3(合理即可);
(2)①得到浅绿色溶液,说明铁与硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为Fe + H2SO4 = FeSO4 + H2↑,故填:Fe + H2SO4 = FeSO4 + H2↑;
②假设只含有一种金属,生成0.2g 氢气,所需金属的质量为、、、,由质量与氢气的质量关系及题干的信息:金属粉末中一定含有铁,且生成0.2g 氢气,固体无剩余可知,金属粉末中一定还含有铝,故填:Fe和Al;
③硫酸中硫酸根与氢元素的质量比为96:2=48:1,所以参与反应的硫酸根质量为48×0.2g=9.6g,由反应的化学方程式可知,所得溶液中溶质的总质量为金属与硫酸根的质量之和,即2.4g +9.6g=12g,故填:12g;
(3)防止金属腐蚀、回收利用废旧金属、合理有效地开采矿物、寻找金属的代用品等都是保护金属资源的有效途径,故选abcd。
19. C 都是混合物的分离提纯 CO2 CO+ CuOCu + CO2
【详解】(1)实验A是探究空气中氧气的含量,实验D是探究氧气的化学性质,实验B和C都是混合物的分离提纯;
(2)氧化性:在反应中提供氧,在反应C + CO22CO中CO2在反应中提供氧,具有氧化性;两种化合物发生反应的化学方程式(其中一种化合物体现氧化性,另一种化合物体 现还原性):一氧化碳还原金属于氧化物:CO+ CuOCu + CO2。
考点:常见化学实验的目的,氧化性的理解,化学方程式的书写
20. 增大和氧气的接触面积 降低可燃物温度至着火点以下 提供反应所需热量和还原剂一氧化碳
【详解】(1)将大块的煤粉碎,目的是增大和氧气的接触面积。(2)燃烧的蜡烛可以用嘴吹灭,原理是降低可燃物温度至着火点以下。(3)炼铁过程中焦炭的作用是提供反应所需热量和还原剂一氧化碳。
21. 微量 80% Cu(NO3)2、Fe(NO3)2 银、铜 O2、CO2、H2O
【详解】(1)铁是人体内所需的微量元素;故填:微量;
(2)设赤铁矿石中,氧化铁的质量为x,则:
x=8g
赤铁矿的纯度为
故填:80%;
(3)在金属活动性顺序中,Fe>Cu>Ag,向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Fe,与两种溶质依次发生反应
Fe+2AgNO3=Fe(NO3)2+2Ag
56 216
所以析出银的过程是溶液质量减少的过程;
Fe+Cu(NO3)2=Fe(NO3)2+Cu
56 64
所以析出铜的过程是溶液质量减少的过程,只是减少的幅度有所减小。
b点时Fe与AgNO3恰好完全反应,没有与Cu(NO3)2反应,此时溶液中含有Cu(NO3)2、Fe(NO3)2;c点表示铁与硝酸铜恰好完全反应,此时溶液中只有硝酸亚铁,固体中一定有银、铜;故填:Cu(NO3)2、Fe(NO3)2;银、铜;
(4)铜绿的主要成分为 Cu2(OH)2CO3.由此可以推测:铜“生锈”过程中,一定含有碳元素的物质参与反应,故参与生锈的物质有铜、氧气、水和二氧化碳,故填:O2、CO2、H2O。
22. A 氧气和水蒸气 将A装置中的空气换作氮气或二氧化碳 b c 刷油漆(其他合理答案均可)
【详解】本题考查了探究铁锈蚀的条件和防止生锈的措施。防止生锈的措施根据金属活动性进行分析。
(1)铁生锈的条件是铁与空气中的水和氧气共同作用的结果,A中铁钉满足铁生锈的条件,一段时间后会出现明显的锈迹;
(2)将A装置中的氧气换做氮气或二氧化碳就可验证空气中氮气或二氧化碳有没有参加铁生锈的反应;
(3)铁比锡活泼,锡层破坏后,铁锈蚀速度加快,故选b;
(4)大门上刷一层银白色金属,该金属可能是镁,因为镁比铁活泼,先腐蚀镁,起到防锈作用,故选C;
(5)铁制品防锈的方法有涂保护层,刷油漆等。
点睛:控制变量法:把多因素的问题变成多个单因素的问题。每一次只改变其中的某一个因素,而控制其余几个因素不变,从而研究被改变的这个因素对事物的影响,分别加以研究,最后再综合解决。
23.(1) 分离固液
(2) 取样灼烧,有烧羽毛味 不完全燃烧 搽拭干净,滴加稀盐酸,无气泡产生
(3) O2 H2O CO 置换反应 二 常温反应
【详解】(1)a、铁和氧气在点燃条件下生成四氧化三铁,反应的反应方程式为:;
b、过滤可以分离固液;
c、硝酸钾、硫、碳在点燃条件下生成硫化钾、氮气和二氧化碳,反应的反应方程式为:;
(2)A、取样灼烧,有烧羽毛味,可以证明笔尖不是化纤制品;
B、徽墨的制作往往需要砍伐许多树枝,点燃后关于窑中,收集窑壁上的碳加入其他成分制作而成,实质是树枝发生了不完全燃烧而形成的;
C、氧化钙俗称生石灰,氧化钙和水反应生成氢氧化钙,该反应符合“多变一”的特征,属于化合反应,反应的反应方程式为:;氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,该反应为两种化合物互相交换成分生成另外两种化合物,属于复分解反应,反应的反应方程式为:;
D、因为石灰石的主要成分是碳酸钙,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,搽拭干净,滴加稀盐酸,无气泡产生,可证明石料不是石灰石;
(3)① 神州十六号飞船的表面都喷有一层油漆,目的是为防止探测器表面的金属生锈,其防锈原理为隔绝O2和H2O;
②由反应的化学方程式可知,反应前有1个硅原子、2个碳原子和2个氧原子,反应后有1个硅原子,反应前后原子的种类和数目不变,剩余2个碳原子和2个氧原子,故其化学式为:CO;该反应符合“一换一”的特征,属于置换反应;
③方法二,在常温反应即可发生,没有二氧化硫生成,相对于反应一更好一些。
答案第1页,共2页
答案第1页,共2页
图片资源预览