2023-2024吉林高三化学第二次模考试卷(图片版无答案)
2024-02-01 19:29:29 学考宝 作者:佚名
Word文档版
学考宝(xuekaobao.com)友情提示:html格式不完整,如有需要请根据文末提示下载并进行二次校对Word文档。
17.(14分)疏铁矿(主要成分是FeS2,含少量A203、SiO2和Fe304)在我国分布广泛,
储量丰富。目前一种利用疏铁矿制备新能源汽车电池的电极LFεPO4的工艺流程如
S0,
试剂R/H2SO4NH4)2HPO4
下
Li,C0、HCa0LiFe
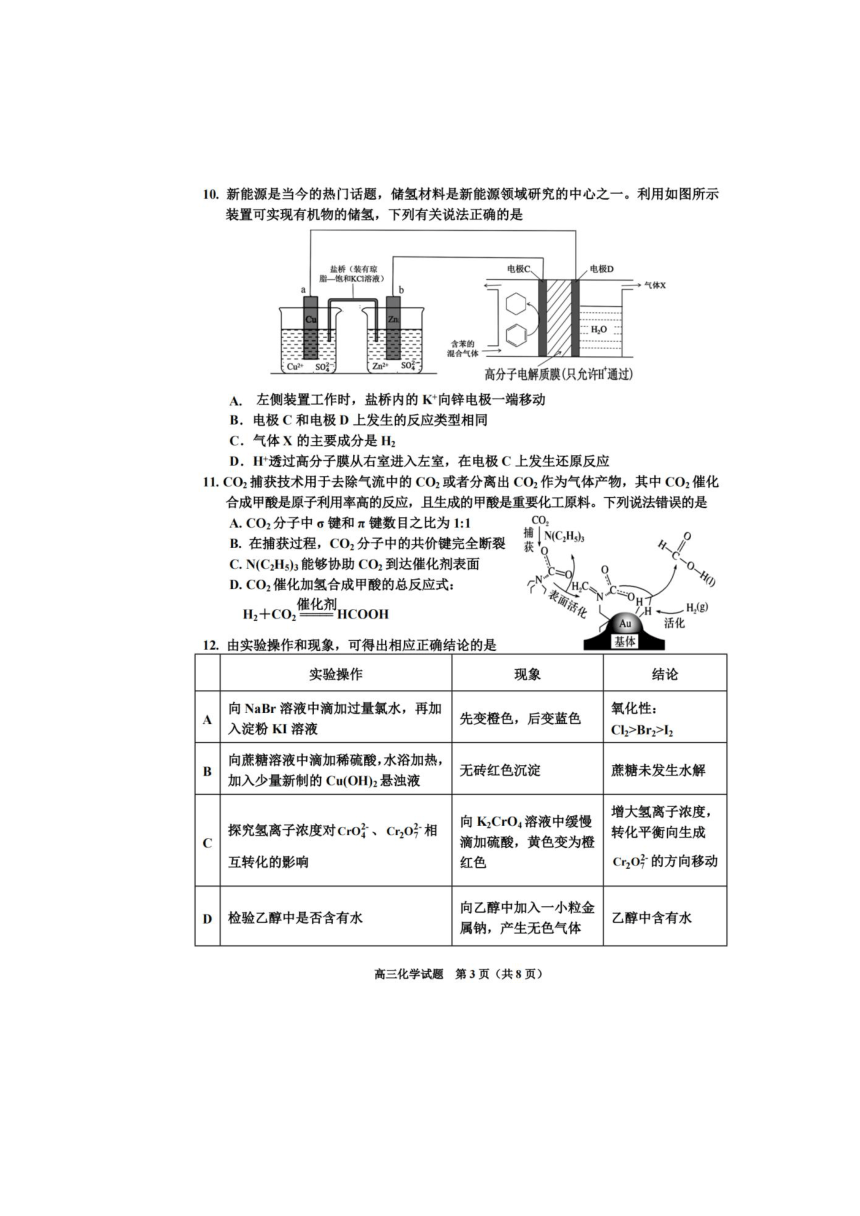
图
硫铁矿
粉末
焙烧…
氧化
沉铁→过滤→FePO
高温煅烧
所
示
空气
滤液
已知几种金属离子沉淀的pH如下表所示,回答下列问题:
金属氢氧化物
Fe(OH)3
Fe(OH)2
Al(OH)3
开始沉淀的pH
2.3
7.5
4.0
完全沉淀的pH
4.1
9.7
5.2
(1)基态Fe原子的价电子排布式为
(2)S02中S的轨道杂化类型是
(3)“焙烧”时,发生的主要反应的化学方程式是
(4)从“焙烧”到“氧化”要经历4步,请从下列步骤选择正确的步骤并合理排
序
FeS
Na S
稀硫酸
FeO
Cuo
a还原
b还原
c酸浸
d过滤
e除铝
f除铝
去滤渣
去滤渣
去滤渣
去滤渣
(5)“氧化”时,氧化的离子是
(6)产品纯度的测定。分别取4.000g产品三次,用稀硫酸溶解,滴加二苯胺磺酸钠
指示剂,用0.2000moL1K2Cr2O,溶液滴定至溶液由浅绿色变为蓝紫色,平
均消耗KCr2O,溶液20.00mL,则产品LiFePO4的纯度为
。(精确到
0.01%)
(7)
磷酸亚铁锂(LiF PO4)的晶胞结构如图所示:
长方体晶胞的长和宽均为anm,高为bnm,
OP
高三化学试题第6页(共
○Li
NA为阿伏加德罗常数的值,晶体的密
度为
gcm-3。
18.(14分)“碳达峰·碳中和”是我国社会发展重大战略之一,CH4还原C02是实现“双
碳”经济的有效途径之一,相关的主要反应有:
I:CHa(g)+CO2(g)2CO(g)+2H2(g)AH=+247 kJ-mol-1
IⅡ:C02(g)+H2(g=C0(g)+H2O(g△H=+41kJmo-1
请回答下列问题:
(1)有利于提高C02平衡转化率的条件是
A.低温低压B.低温高压C.高温低压
D.高温高压
(2)反应CH4(g)+3C02(g)=4C0(g)+2H20(g)的△H=
kJ.mol-1。
(3)恒温恒压条件下,1 mol CH4(g)和1 mol CO2(g)反应达平衡时,CH4(g)的转化率为
a,H20(g)的物质的量为bmol,则反应I的平衡常数K、=
(写出含有
a、b的计算式;对于反应mA(g+nB(g)
=pC(g)+qD(g),
K,=XC:D,x为物质的量分数。
CH,+CO
CaCO.
Fe
He
x"(A)x"(B)
进
(4)恒压、750C时,CH4和C02按物质的量之比1:3
投料,反应经如下流程(主要产物己标出)可实
Ca0
CO+He
C0+H,+C02
现C02高效转化。
Fe,0,
H,0
①下列说法正确的是
A.Fe3O4可循环利用,CaO不可循环利用
B.过程i,Ca0吸收CO2,可促使
Fe3O4氧化CO的平衡正移
C.过程产生的H0最终未被CaO吸收,
在过程被排出
D.相比于反应I,该流程的总反应还原1 molCO2需吸收的能量更多
②过程i平衡后通入H ,测得一段时间内CO物质的量上升,根据过程i,结合
平衡移动原理,解释C0物质的量上升的原因
温度/°C
480
500
520
550
高三化学试题第7页(共8页)
图片资源预览