第八单元 水溶液中的离子平衡——水的电离及溶液的酸碱性 (含答案)学案——2024届人教版(2019)高中化学一轮复习
2023-10-30 12:56:42 学考宝 作者:佚名
Word文档版
学考宝(xuekaobao.com)友情提示:html格式不完整,如有需要请根据文末提示下载并进行二次校对Word文档。
第八单元 水溶液中的离子平衡
第2节 水的电离及溶液的酸碱性
【核心素养】
1.了解水的电离和离子积常数。(变化观念与平衡思想)
2.了解溶液pH的含义及其测定方法,能进行pH的简单计算。(证据推理及模型认知)
【考点解读】
一、水的电离(★★★★)
1.水的电离
水是极弱的电解质,水的电离方程式:H2O+H2OH3O++OH-或 H2OH++OH-。
2.水的离子积常数
Kw=c(H+)·c(OH-)。
①室温下:Kw=1×10-14。
②影响因素:只与温度有关,升高温度,Kw增大。
③适用范围:Kw不仅适用于纯水,也适用于稀的电解质水溶液。
④Kw揭示了在任何水溶液中均存在H+和OH-,只要温度不变,Kw不变。
3.影响
条件变化 移动方向 c(H+) c(OH-) Kw 电离程度
升温 右移 增大 增大 增大 增大
加酸 左移 增大 减小 不变 减小
加碱 左移 减小 增大 不变 减小
加活泼金属 右移 减小 增大 不变 增大
加醋酸钠 右移 减小 增大 不变 增大
加氯化铵 右移 增大 减小 不变 增大
【基础测评】
1.易错易混辨析(正确的画“√”,错误的画“ ”)。
(1)在蒸馏水中滴加浓H2SO4,KW不变 ( )
(2)NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 ( )
(3)室温下,0.1 mol·L-1的盐酸与0.1 mol·L-1的NaOH溶液中水的电离程度相等 ( )
(4)任何水溶液中均存在H+和OH-,且水电离出的c(H+)和c(OH-)相等( )
(5)25 ℃时NH4Cl溶液的KW小于100 ℃时NaCl溶液的KW( )
(6)由水电离的c(H+)=1×10-14 mol·L-1的溶液中:C、K+、Cl-、HC能大量共存 ( )
(7)KW=c(H+)·c(OH-)中,H+和OH-均是由水电离产生的 ( )
答案: √ √ √
2.某温度下纯水中c(H+)=2×10-7 mol·L-1,则此时c(OH-)为 ;若温度不变,滴入稀盐酸使c(H+)=5×10-4 mol·L-1,则溶液中c(OH-)为 ,由水电离产生的c(H+)为 ,此时温度 (填“高于”“低于”或“等于”)25 ℃。
答案:2×10-7mol·L-1 8×10-11 mol·L-1 8×10-11 mol·L-1 高于
3.25 ℃时,水的电离达到平衡:H2OH++OH-(ΔH>0),下列叙述正确的是 ( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)减小
B.向水中加入少量硫酸氢钠固体,c(H+)增大,KW不变
C.向水中加入少量NaCl固体,平衡逆向移动,c(H+)减小
D.将水加热,KW增大,pH不变
答案:B
4.25 ℃时,在等体积的①pH=0的H2SO4溶液、②0.05 mol·L-1的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是 ( )
A.1∶10∶1010∶109 B.1∶5∶5×109∶5×108
C.1∶20∶2010∶109 D.1∶10∶104∶109
答案:A
5.求算常温下下列溶液中由H2O电离的c(H+)和c(OH-)。
(1)pH=2的H2SO4溶液c(H+)= ,c(OH-)= 。
(2)pH=10的NaOH溶液c(H+)= ,c(OH-)= 。
(3)pH=2的NH4Cl溶液c(H+)= 。
(4)pH=10的Na2CO3溶液c(OH-)= 。
答案:(1)10-12 mol·L-1 10-12 mol·L-1 (2)10-10 mol·L-1 10-10 mol·L-1 (3)10-2 mol·L-1 (4)10-4 mol·L-1
6.如图表示水中c(H+)和c(OH-)的关系,下列判断正确的是 ( )
A.各点的温度高低顺序:Z>Y>X
B.M区域内任意点都是碱溶于水所得的溶液
C.常温下,向纯水中加入少量金属Na,
可使X点溶液变为Y点
D.XZ线上的任意点一定表示的是纯水
答案:C
二、溶液的酸碱性与pH(★★★★)
1.溶液酸碱性的判断方法
2.pH
(1)定义:pH=-lgc(H+),广范pH的范围为1~14。
②适用范围:通常应用于c(H+)、c(OH-)都较小的稀溶液,小于1 mol·L-1。
(3)表示意义:溶液酸性越强,c(H+)越大,pH 越小;溶液碱性越强,c(H+)越小,pH 越大。
3.溶液pH的测量方法
①用pH试纸测定:撕下一小片pH试纸放在表面皿或玻璃片上,用干燥洁净的_玻璃棒_蘸取待测液点在 pH 试纸的中央,试纸变色后,与标准比色卡对比即可确定溶液的 pH。
②用 pH 计测定:可精确测量溶液的 pH。
注意:pH试纸在使用前不能用蒸馏水润湿,否则待测液被稀释可能会产生误差。广范pH试纸只能测出整数值。
4.溶液pH的计算方法
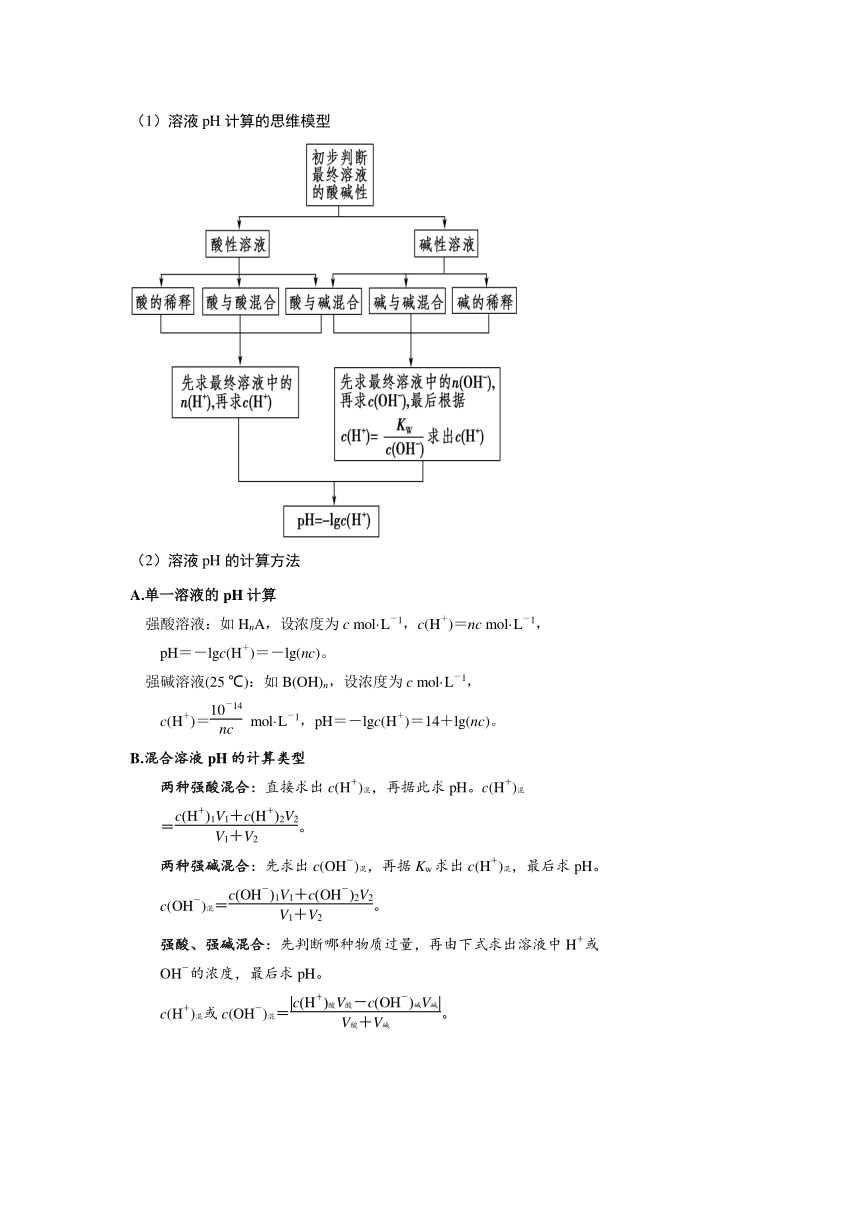
(1)溶液pH计算的思维模型
(2)溶液pH的计算方法
A.单一溶液的pH计算
强酸溶液:如HnA,设浓度为c mol·L-1,c(H+)=nc mol·L-1,
pH=-lgc(H+)=-lg(nc)。
强碱溶液(25 ℃):如B(OH)n,设浓度为c mol·L-1,
c(H+)= mol·L-1,pH=-lgc(H+)=14+lg(nc)。
B.混合溶液pH的计算类型
两种强酸混合:直接求出c(H+)混,再据此求pH。c(H+)混
=。
两种强碱混合:先求出c(OH-)混,再据Kw求出c(H+)混,最后求pH。
c(OH-)混=。
强酸、强碱混合:先判断哪种物质过量,再由下式求出溶液中H+或
OH-的浓度,最后求pH。
c(H+)混或c(OH-)混=。
【基础测评】
1.用“酸性”“碱性”“中性”或“不确定”填空。
(1)pH<7的溶液: 。
(2)pH=7的溶液: 。
(3)c(H+)=c(OH-)的溶液: 。
(4)c(H+)=1×10-7 mol·L-1的溶液: 。
(5)c(H+)>c(OH-)的溶液: 。
(6)0.1 mol·L-1的NH4Cl溶液: 。
(7)0.1 mol·L-1的NaHCO3溶液: 。
(8)0.1 mol·L-1的NaHSO3溶液: 。
答案:(1)不确定 (2)不确定 (3)中性 (4)不确定 (5)酸性 (6)酸性
(7)碱性 (8)酸性
2.计算下列溶液的pH(25 ℃)。
(1)0.1 mol·L-1的盐酸的pH= ;
(2)0.005 mol·L-1的稀硫酸的pH= ;
(3)0.1 mol·L-1的NaOH溶液的pH= ;
(4)0.005 mol·L-1的Ba(OH)2溶液的pH= ;
(5)0.15 mol·L-1的盐酸与0.35 mol·L-1的NaOH溶液等体积混合后溶液的pH= 。
答案:1 2 13 12 13
3.(2018河南安阳模拟)下列溶液一定呈酸性的是 ( )
A.含H+的溶液
B.c(OH-)
C.pH<7的溶液
D.能与金属Al反应放出H2的溶液
答案:B
4.常温下,用“酸性”“碱性”“中性”或“不确定”填空。
(1)相同浓度的盐酸和NaOH溶液等体积混合: 。
(2)相同浓度的CH3COOH溶液和NaOH溶液等体积混合: 。
(3)相同浓度的氨水和盐酸等体积混合: 。
(4)25 ℃时,pH=2的盐酸和pH=12的NaOH溶液等体积混合: 。
(5)25 ℃时,pH=3的盐酸和pH=10的NaOH溶液等体积混合: 。
(6)25 ℃时,pH=3的盐酸和pH=12的NaOH溶液等体积混合: 。
(7)25 ℃时,pH=2的CH3COOH溶液和pH=12的NaOH溶液等体积混合: 。
(8)25 ℃时,pH=2的盐酸和pH=12的氨水等体积混合: 。
答案: (1)中性 (2)碱性 (3)酸性 (4)中性 (5)酸性 (6)碱性 (7)酸性 (8)碱性
5.常温下,现有pH=5的CH3COOH溶液10 mL,要使pH增大3,可采取的方法有 ( )
A.向溶液中加水稀释至10 L
B.加入一定量的NaOH固体
C.加入一定量pH=8的NaOH溶液
D.加入一定浓度的盐酸
答案:B
6.若用AG表示溶液的酸度,AG的定义为AG=lg。室温下实验室中用0.01 mol·L-1的氢氧化钠溶液滴定20.00 mL 0.01 mol·L-1醋酸,滴定过程如图所示,下列叙述正确的是 ( )
A.室温下,醋酸的电离常数约为10-5
B.A点时加入氢氧化钠溶液的体积为20.00 mL
C.若B点为40 mL,所得溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)
D.从A到B,水的电离程度逐渐变大
答案:A
三、酸碱中和滴定
1.实验原理:利用酸碱中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸) 的实验方法。
2.常用酸碱指示剂及其变色范围
指示剂 pH的变色范围
石蕊 <5红色 5~8紫色 >8蓝色
甲基橙 <3.1红色 3.1~4.4橙色 >4.4黄色
酚酞 <8无色 8~10浅红 >10红色
3.实验用品
①仪器
(图 A 是)酸式滴定管、(图 B 是)碱式滴定管、滴定管夹、铁架台、锥形瓶。
②试剂:标准液、待测液、指示剂、蒸馏水。
③滴定管的使用
试剂性质 滴定管 原因
酸性、氧化性 _酸式_滴定管 氧化性物质易腐蚀橡胶管
碱性 _碱式_滴定管 碱性物质易腐蚀玻璃,致使玻璃活塞无法打开
4.实验操作
滴定终点的判断:(以盐酸滴定氢氧化钠溶液为例,酚酞作指示剂)当滴入最后一滴盐酸时,溶液变为无色,且半分钟内不恢复原色 ,即为滴定终点。
5.数据处理
按上述操作重复2~3次,求出用去标准盐酸体积的平均值,根据原理计算。
c(NaOH)=
6.滴定曲线
原理:在酸碱中和滴定过程中,开始时由于被滴定的酸(或碱)浓度较大,滴入少量的碱(或酸)对其pH的影响不大。当滴定接近终点(pH=7)时,很少量(一滴,约0.04 mL)的碱(或酸)就会引起溶液pH的突变(如图所示)。
7.误差分析
①原理:依据原理c(标准)·V(标准)=c(待测)·V(待测),所以c(待测)=,因为c(标准)与V(待测)已确定,所以只要分析出不正确操作引V(标准)的变化,即分析出结果。
②常见误差
步骤 操作 c(NaOH)
洗涤 未用标准溶液润洗酸式滴定管 偏高
锥形瓶用待测溶液润洗 偏高
未用待测溶液润洗取用待测液的滴定管 偏低
锥形瓶洗净后瓶内还残留有少量蒸馏水 无影响
取液 取碱液的滴定管尖嘴部分有气泡且取液结束前气泡消失 偏低
滴定 滴定完毕后立即读数,半分钟后颜色又变红 偏低
滴定前滴定管尖嘴部分有气泡,滴定后消失 偏高
滴定过程中振荡时有液滴溅出 偏低
滴定过程中,向锥形瓶内加少量蒸馏水 无影响
读数 滴定前仰视读数或滴定后俯视读数 偏低
滴定前俯视读数或滴定后仰视读数 偏高
【基础测评】
1.易错易混辨析(正确的画“√”,错误的画“ ”)。
(1)用碱式滴定管量取20.00 mL的高锰酸钾溶液 ( )
(2)滴定终点就是酸、碱恰好中和的点 ( )
(3)滴定管和锥形瓶都应该用待装的溶液润洗2~3次 ( )
(4)酸碱中和滴定实验要重复进行2~3次,求算标准溶液体积的平均值 ( )
(5)用碱式滴定管准确量取20.00 mL的NaOH溶液 ( )
(6)将液面在0 mL处的25 mL的酸式滴定管中的液体全部放出,液体的体积为25 mL ( )
(7)中和滴定操作中所需标准溶液越浓越好,指示剂一般加入2~3 mL ( )
(8)滴定终点溶液一定呈中性 ( )
答案: √ √
2.Ⅰ.用标准盐酸滴定未知浓度的NaOH溶液(酚酞作指示剂),用“偏高”“偏低”或“无影响”填空。
(1)酸式滴定管未用标准溶液润洗 。
(2)锥形瓶用待测液润洗 。
(3)锥形瓶洗净后还留有蒸馏水 。
(4)放出碱液的滴定管开始有气泡,放出液体后气泡消失 。
(5)酸式滴定管滴定前有气泡,滴定终点时气泡消失 。
(6)部分酸液滴出锥形瓶外 。
(7)酸式滴定管滴定前读数正确,滴定后俯视读数(或前仰后俯) 。
(8)酸式滴定管滴定前读数正确,滴定后仰视读数(或前俯后仰) 。
Ⅱ.(1)用a mol·L-1的盐酸滴定未知浓度的NaOH溶液,用酚酞作指示剂,达到滴定终点的现象是 。
(2)用标准碘溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,应选用 作指示剂,达到滴定终点的现象是 。
(3)用标准酸性KMnO4溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,是否需要选用指示剂 (填“是”或“否”),达到滴定终点的现象是 。
(4)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再用KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+,滴定Ti3+时发生反应的离子方程式为 ,达到滴定终点时的现象是 。
答案 Ⅰ.(1)偏高 (2)偏高 (3)无影响 (4)偏低 (5)偏高 (6)偏高 (7)偏低 (8)偏高
Ⅱ.(1)当滴入最后一滴标准液,溶液由红色变为无色,且半分钟内不恢复红色
(2)淀粉溶液 当滴入最后一滴标准液,溶液由无色变为蓝色,且半分钟内不褪色
(3)否 当滴入最后一滴酸性KMnO4溶液,溶液由无色变为紫红色,且半分钟内不褪色
(4)Ti3++Fe3+=Ti4++Fe2+ 当滴入最后一滴标准液,溶液变成红色,且半分钟内不褪色
3.下图曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是 ( )
A.盐酸中HCl的物质的量浓度为1 mol·L-1
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
D.酚酞不能用作本实验的指示剂
答案:B
4.(2018河南豫北、豫南第二次联考)已知:25 ℃时,Kb(NH3·H2O)=1.8×10-5。该温度下,用0.100 mol·L-1的氨水滴定10.00 mL 0.100 mol·L-1的一元酸HA的溶液,滴定过程中加入氨水的体积(V)与溶液中lg的关系如图所示。下列说法中不正确的是 ( )
A.HA为强酸
B.a=10
C.25 ℃时,N的水解平衡常数为×10-9
D.当滴入20 mL氨水时,溶液中存在c(N)>c(A-)
答案 B
【真题演练】
1.(2022·山东·高考真题)实验室用基准配制标准溶液并标定盐酸浓度,应选甲基橙为指示剂,并以盐酸滴定标准溶液。下列说法错误的是( )
A.可用量筒量取标准溶液置于锥形瓶中
B.应选用配带塑料塞的容量瓶配制标准溶液
C.应选用烧杯而非称量纸称量固体
D.达到滴定终点时溶液显橙色
答案A
2.(2022·上海普陀·二模)水的电离平衡曲线如图所示,下列说法正确的是( )
A.T1>T2
B.Kw:b>c>a>d=e
C.b→c点可通过在水中加入适量的CH3COONa(s)实现
D.T2时,将pH=10的NaOH(aq)与pH=3的H2SO4(aq)等体积混合,溶液呈碱性
答案D
3.(2020·全国·高考真题)以酚酞为指示剂,用0.1000 mol·L 1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2 的分布系数:]
下列叙述正确的是( )
A.曲线①代表,曲线②代表
B.H2A溶液的浓度为0.2000 mol·L 1
C.HA 的电离常数Ka=1.0×10 2
D.滴定终点时,溶液中
答案C
4.(2022·江西宜春·模拟预测)室温下,向20.00mL0.1000mol·L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸,混合溶液的温度、酸度AG[AG=lg]随加入稀硫酸体积的变化如图所示。下列叙述正确的是( )
A.室温下MOH的电离常数Kb=1.0 ×10-4
B.当AG=0时,溶液中存在c( )>c(M+ )>c(H+ )=c(OH- )
C.b、c、d三点对应的溶液中,水的电离程度的大小关系是b=d>c
D.a点对应的溶液中c(M+ )+c(MOH)=8c( )
答案D
5.(2022·河南·模拟预测)25℃时,用0. 10mol·L -1的氨水滴定10. 00mL0. 05 mol·L-1二元酸H2A溶液,滴定过程中加入氨水的体积(V)与溶液中lg的关系如图所示。下列说法正确的是( )
A.H2A 属于二元弱酸
B.N点溶液中,水电离c (H+) =1.0×10-6mol·L-1
C.P点溶液中,c (NH3·H2O) = (10-5.5-10-8.5)mol·L-1
D.25℃时,该氨水的电离平衡常数为Kb≈
答案C
图片资源预览