浙江省衢州、丽水、湖州三地市 2023-2024学年高三上学期11月教学质量检测化学试题(含答案)
2023-11-14 12:35:21 学考宝 作者:佚名
Word文档版
学考宝(xuekaobao.com)友情提示:html格式不完整,如有需要请根据文末提示下载并进行二次校对Word文档。
衢州、丽水、湖州三地市 2023-2024学年高三上学期11月教学质量检测
化学试题卷
考生须知:
1.本卷满分100分,考试时间90分钟;
2.答题前,在答题卷指定区域填写学校、班级、姓名、试场号、座位号及准考证号;
3.所有答案必须写在答题卷上,写在试卷上无效;
4.考试结束后,只需上交答题卷。杭州小姜小范小张提供
可能用到的相对原子质量:H-l C-12 O-16 Na-23 Mg-24 S-32 Ni-59
一、选择题(本大题共16小题,每小题3分,共48分。每个小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.下列物质属于电解质,且在熔融状态下能导电的是( )
A.水银 B.生石灰 C.硝酸 D.二氧化硅
2.物质的性质决定用途,下列两者对应关系不正确的是( )
A.ClO2具有强氧化性,可用作消毒剂
B.FeCl3溶液显酸性,可用作印刷电路板的腐蚀液
C.维生素C具有还原性,可用作食品抗氧化剂
D.液氨汽化需要吸收大量的热,可用作制冷剂
3.下列化学用语表示正确的是( )
A.MgCl2的形成过程:
B.反式聚异戊二烯的结构简式:
C.水分子的VSEPR模型:
D.氮的基态原子轨道表示式:
4.下列关于元素及其化合物的性质说法正确的是( )
A.工业上利用水和NO2反应制备硝酸
B.工业上用焦炭和金刚砂反应制备粗硅
C.用铁与浓硫酸常温下反应制备SO2
D.La-Ni储氢合金在加热条件下可与氢气反应生成稳定的金属氢化物
5.砒霜(As2O3)有毒,由于古代技术落后,制成的砒霜中含有大量硫化物。“银针验毒”的原理是,从而使银针表面变黑。下列说法不正确的是( )
A.X的化学式为Ag2S B.纯净的砒霜也能使银针表面变黑
C.反应中Ag是还原剂 D.每生成1molX,反应转移电子数为2NA
6.下列说法不正确的是( )
A.图①:进行化学实验时,需要佩戴护目镜,以保护眼睛
B.图②:可用于分离植物油和水的混合液
C.图③:可用于硫酸钠的焰色试验
D.图④:牺牲阳极法保护钢铁设备的示意图
7.下列方程式与所给事实不相符的是( )
A.硫酸亚铁溶液出现棕黄色沉淀:
B.向银氨溶液中滴加乙醛溶液并水浴加热:
C.乙炔制丙烯腈:
D.用硫化亚铁除去废水中的汞离子:
8.下列说法正确的是( )
A.油脂在酸性溶液中的水解反应可称为皂化反应
B.苯中含少量苯酚,可加入浓溴水,充分反应后过滤除去
C.氨基酸既能与HCl反应,也能与NaOH反应,产物均为盐和水
D.乙醛和氢气混合气体通过热的镍催化剂,乙醛发生还原反应
9.某有机物在抗真菌和抑制组胺活性物质释放等方面有广泛应用,其结构如图。下列说法不正确的是( )
第9题图
A.该物质能与FeCl3发生显色反应
B.该分子中共平面的碳原子最多有15个
C.该物质与H2完全加成后的产物中含5个手性碳原子
D.1 mol该物质与足量溴水反应,最多可消耗3 mol Br2
10.W、X、Y、Z、M五种短周期元素,原子序数依次增大。W最外层电子数是次外层的3倍,X的s能级与p能级电子数相等,Z的单质可做半导体材料,M原子核外有9种不同空间运动状态的电子且只有一个不成对电子。下列说法正确的是( )
A.X、Y、M简单离子的半径:
B.第一电离能:
C.ZW2的熔点比ZM4的熔点低
D.工业上用电解熔融氯化物的方法制取X、Y单质
11.一种检测空气中甲醛含量的电化学传感器的工作原理如图所示。下列说法正确的是( )
第11题图
A.工作时,电能转化为化学能
B.工作时,工作电极电势低,发生还原反应
C.工作时,电子由工作电极通过导线转移到对电极,再经过电解质溶液回到工作电极
D.工作时,对电极区的电极反应为
12.加热煮沸的浓NaOH溶液和白磷反应可制PH3,该过程同时可获得P2H4。其中一个反应为。下列说法不正确的是( )
A.稳定性:P2H4大于N2H4
B.反应过程中有极性键、非极性键的断裂,也有极性键、非极性键的形成
C.P4、PH3与P2H4的晶体类型相同
D.PH3分子中键角∠HPH小于NH3分子中∠HNH
13.苯酚是重要的化工原料,将废水中的苯酚富集并加入Na2CO3;转化为苯酚钠,再通入CO2,可进一步分离回收。已知:,,。下列说法正确的是( )
A.Na2CO3;也可用NaOH或NaHCO3替代
B.的平衡常数K约为9.57×103
C.转化反应中若,此时溶液中
D.当通入CO2至溶液pH=10时,溶液中的C6H5ONa完全转化为C6H5OH
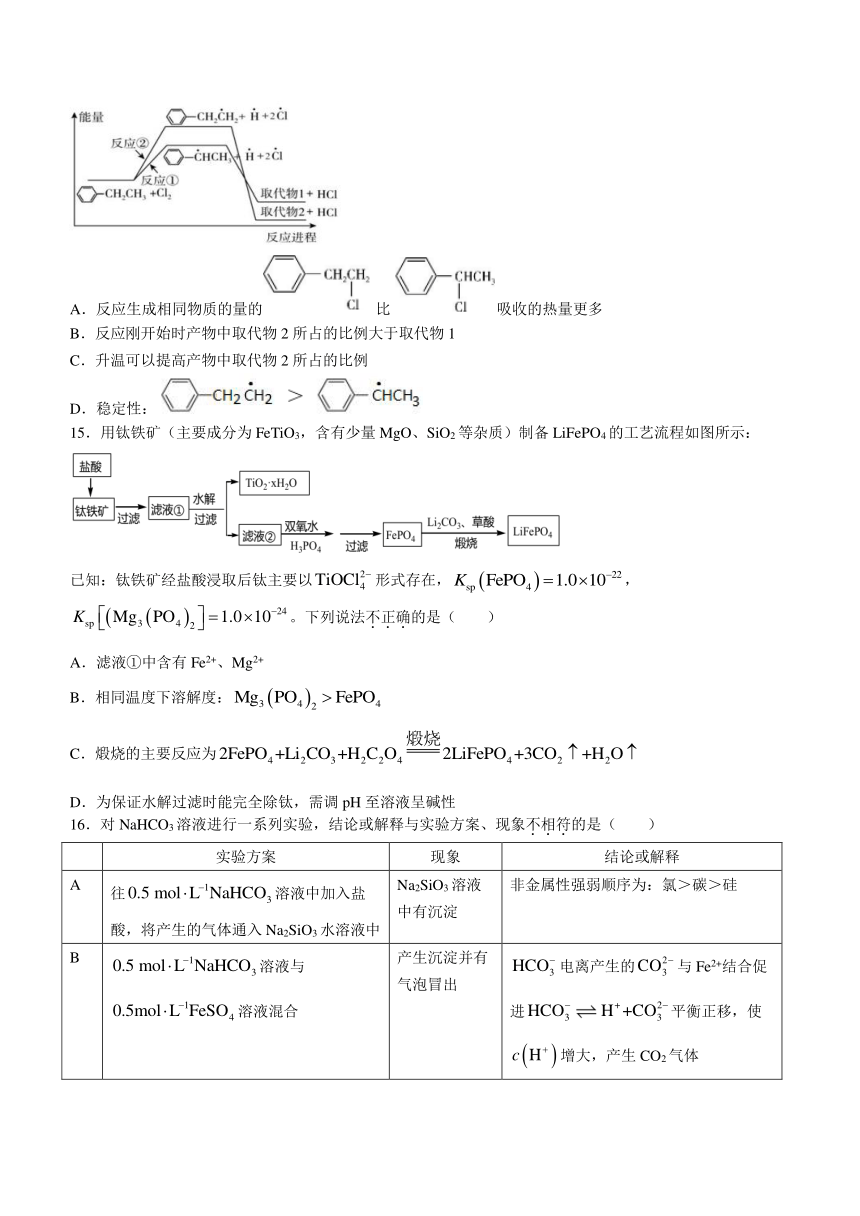
14.乙苯与氯气在光照条件下反应生成两种一氯取代物,反应过程中的能量变化如下图所示。下列说法正确的是( )
A.反应生成相同物质的量的比吸收的热量更多
B.反应刚开始时产物中取代物2所占的比例大于取代物1
C.升温可以提高产物中取代物2所占的比例
D.稳定性:
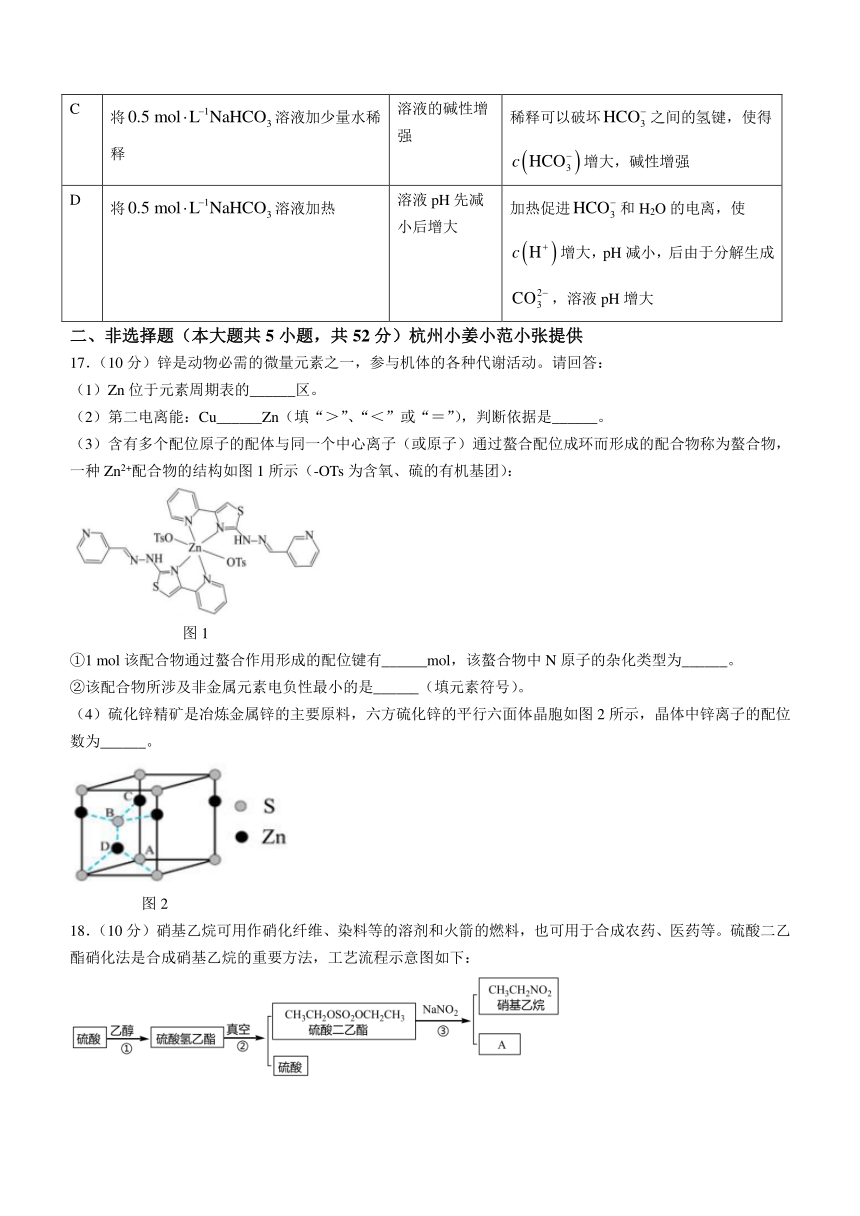
15.用钛铁矿(主要成分为FeTiO3,含有少量MgO、SiO2等杂质)制备LiFePO4的工艺流程如图所示:
已知:钛铁矿经盐酸浸取后钛主要以形式存在,,。下列说法不正确的是( )
A.滤液①中含有Fe2+、Mg2+
B.相同温度下溶解度:
C.煅烧的主要反应为
D.为保证水解过滤时能完全除钛,需调pH至溶液呈碱性
16.对NaHCO3溶液进行一系列实验,结论或解释与实验方案、现象不相符的是( )
实验方案 现象 结论或解释
A 往溶液中加入盐酸,将产生的气体通入Na2SiO3水溶液中 Na2SiO3溶液中有沉淀 非金属性强弱顺序为:氯>碳>硅
B 溶液与溶液混合 产生沉淀并有气泡冒出 电离产生的与Fe2+结合促进平衡正移,使增大,产生CO2气体
C 将溶液加少量水稀释 溶液的碱性增强 稀释可以破坏之间的氢键,使得增大,碱性增强
D 将溶液加热 溶液pH先减小后增大 加热促进和H2O的电离,使增大,pH减小,后由于分解生成,溶液pH增大
二、非选择题(本大题共5小题,共52分)杭州小姜小范小张提供
17.(10分)锌是动物必需的微量元素之一,参与机体的各种代谢活动。请回答:
(1)Zn位于元素周期表的______区。
(2)第二电离能:Cu______Zn(填“>”、“<”或“=”),判断依据是______。
(3)含有多个配位原子的配体与同一个中心离子(或原子)通过螯合配位成环而形成的配合物称为螯合物,一种Zn2+配合物的结构如图1所示(-OTs为含氧、硫的有机基团):
图1
①1 mol该配合物通过螯合作用形成的配位键有______mol,该螯合物中N原子的杂化类型为______。
②该配合物所涉及非金属元素电负性最小的是______(填元素符号)。
(4)硫化锌精矿是冶炼金属锌的主要原料,六方硫化锌的平行六面体晶胞如图2所示,晶体中锌离子的配位数为______。
图2
18.(10分)硝基乙烷可用作硝化纤维、染料等的溶剂和火箭的燃料,也可用于合成农药、医药等。硫酸二乙酯硝化法是合成硝基乙烷的重要方法,工艺流程示意图如下:
已知:硫酸结构简式为
请回答:
(1)步骤①的化学方程式______。
(2)下列有关说法不正确的是______。
A.硫酸氢乙酯具有酸性
B.相同温度下,硫酸二乙酯在水中的溶解性大于硫酸
C.NaNO2具有一定毒性,不能作为食品添加剂使用
D.若③中硫酸二乙酯和NaNO2等物质的量反应,则A化学式为CH3CH2OSO2ONa
(3)硫酸氢乙酯沸点为280℃,硫酸二乙酯的沸点为208℃,试从结构角度分析硫酸氢乙酯沸点高于硫酸二乙酯的原因______。
(4)设计实验验证固体NaNO2有还原性(可供选择的试剂有:酸性KMnO4溶液、KI溶液、H2O2溶液、FeSO4溶液)______;写出实验过程中涉及的离子反应方程式______。
19.(10分)合成氨是人工固氮最重要的途径。
合成氨反应为: 。
请回答:
(1)该反应能自发进行的条件是______。
(2)现代常用工艺条件以Fe作催化剂,一定压强下,控制温度500℃,反应历程为(*表示吸附态)
化学吸附:(速率慢);(速率快)
表面反应:;;(速率快)
脱附:(速率快)
关于合成氨工艺的下列理解,正确的是______。
A.控制温度远高于室温,是为了提高平衡转化率
B.原料气须经过净化处理,以防止催化剂中毒和安全事故发生
C.不断将液氨移去,利于反应正向进行同时提高正反应速率
D.实际生产中,N2适度过量有利于提高H2的转化率同时有利于提高整体反应速率
(3)为降低合成氨的能耗,我国科学家提出使用M-LiH复合催化剂,催化效果如图1所示。若一定压强下,以相同的投料,500℃用Fe作催化剂和350℃用Fe-LiH作催化剂,氨气的产率随时间变化如图2。请在图2中画出相同压强下350℃用Cr-LiH作催化剂氨气的产率随时间变化的曲线。
图1 图2
(4)压强为20MPa下,以、(x代表物质的量分数)进料,反应达平衡时氮气的转化率与温度的结果如下图3中曲线b所示。
图3
①若保持压强不变,以、、进料,则平衡时氮气的转化率与温度的结果是曲线______(填“a”或“c”)。判断的依据是______。
②若保持压强不变,当平衡时,则该温度0下,反应平衡常数______(化为最简式)。[对于气相反应,用某组分B的平衡压强代替物质的量浓度也可表示平衡常数,记作,如,p为平衡总压强,为平衡系统中B的物质的量分数]。
20.(10分)废镍催化剂主要含Ni,还有少量Cu、Fe、Al及其氧化物、SiO2。某研究小组设计如图所示工艺流程制备硫酸镍晶体。
查阅资料:
①镍的化学性质与铁相似,能与酸缓慢反应。
②一定条件下,一些金属氢氧化物沉淀时的pH如下表:
金属离子 Ni2+ Al3+ Fe3+ Fe2+
开始沉淀的pH 7.2 4.0 2.2 7.5
沉淀完全的pH 9.0 5.6 3.2 9.0
(1)“滤渣2”的成分是______(用化学式表示)。溶液中加入H2O2的目的是______(用离子方程式表示)。
(2)“调pH”可选用的物质______(填序号)。
A.Na2CO3 B.NiCO3 C.H2SO4 D.NiSO4
“调pH”的范围为______。
(3)下列有关说法不正确的是______。
A.酸浸步骤可用水浴加热,以加速反应
B.操作A中的有机溶剂可选用乙醇
C.调pH后过滤,需用玻璃棒对漏斗中的混合物充分搅拌
D.操作B中包含“结晶、过滤、洗涤、煅烧”等操作
(4)测定产品的纯度。
操作步骤 涉及反应
①准确称取制备的硫酸镍样品5.620 g,加入含0.0200 mol EDTA的二钠盐溶液(用H2Y2-表示),充分反应后定容成100 mL。
②取25.00 mL上述溶液于锥形瓶中,加二甲酚橙作指示剂,用标准液滴定到终点,平行实验三次,平均消耗20.00 mL Zn2+标准液。
计算产品的纯度为______。
21.(12分)某研究小组按下列路线合成降压药尼卡地平。
已知:
(1)化合物C中含氧官能团的名称为硝基、______。
(2)写出B→C的化学方程式______。
(3)下列说法正确的是______。
A.A→B的反应类型为取代反应
B.1 mol E与足量H2反应,最多可消耗2 mol H2
C.1 mol F与足量NaOH溶液反应,最多可消耗3 mol NaOH
D.尼卡地平的分子式为C26H27N3O6
(4)化合物G的结构简式为______。
(5)设计以CH3OH、CH3CHO为原料合成E()的合成路线(用流程图表示,无机试剂任选)______。
(6)写出同时符合下列条件的化合物B的同分异构体的结构简式______。
①分子中含(结构与苯相似),无其他环;
②能发生银镜反应;
③1H-NMR谱检测表明:分子中有3种不同化学环境的氢原子。
衢州、丽水、湖州三地市 2023-2024学年高三上学期11月教学质量检测
化学答案
一、选择题
1 2 3 4 5 6 7 8
B B C A B D A D
9 10 11 12 13 14 15 16
C A D A C C D A
二、非选择题(本大题共5小题,共52分)
17.(10分)杭州小姜小范小张提供
(1)ds(1分)
(2)>(1分) Cu和Zn失去一个电子后价层电子排布分别为3d10、3d104s1,前者属于全充满状态,再失去一个电子更难。(描述出价层电子排布1分,共2分)
(3)①4(1分) sp2 sp3(2分) ②H(1分)
(4)4(2分)
18.(10分)(1)(2分,缺“H2O”其他正确给1分)
(2)BC(2分)
(3)硫酸氢乙酯可形成分子间氢键(2分)
(4)取NaNO2固体于试管中,加适量水溶解,逐滴加入少量酸性KMnO4溶液,溶液不出现紫红色,则NaNO2有还原性。(2分,其他答案合理也给分)
(2分,配平错误得1分)
19.(10分)(1)低温(1分) (2)BD(2分)
(3)(2分)
图2
(4)①a(1分) 相同温度下,恒压充入稀有气体反应物分压减小(1分), 平衡逆向移动(1分)。(共2分,其他答案合理也给分) ②(2分)
20.(10分)(1)、(2分)
(2分,未配平得1分)
(2)B(1分) 5.6≤pH<7.2(1分,5.6~7.2等不同书写形式均给分)
(3)BCD(2分,选对2个给1分)
(4)90.0%(2分,有效数字不作要求)
21.(12分)(酮)羰基、酯基(1分,漏写不给分)
(2)(2分,缺“H2O”其他正确得1分)
(3)AC(2分) (4)(1分)
(5)(3分;第1、2步1分,第3步1分,第4步1分)
(6)(3分;写出2个1分,3个2分,4个3分)
图片资源预览