专题2 化学反应速率与化学平衡(含解析) 达标检测卷 2023-2024学年高二上学期化学苏教版(2019)选择性必修1
2023-10-22 19:15:54 学考宝 作者:佚名
Word文档版
学考宝(xuekaobao.com)友情提醒:html格式不完整,如有需要请根据文末提示下载并进行二次校对Word文档。
专题2 化学反应速率与化学平衡 达标检测卷
一、选择题
1.实验室常用锌粒与盐酸反应制取H2,下列措施不能提高该反应反应速率的是( )
A.用水将盐酸稀释 B.用锌粉代替锌粒
C.适当提高盐酸浓度 D.向反应液中滴入少量CuCl2溶液
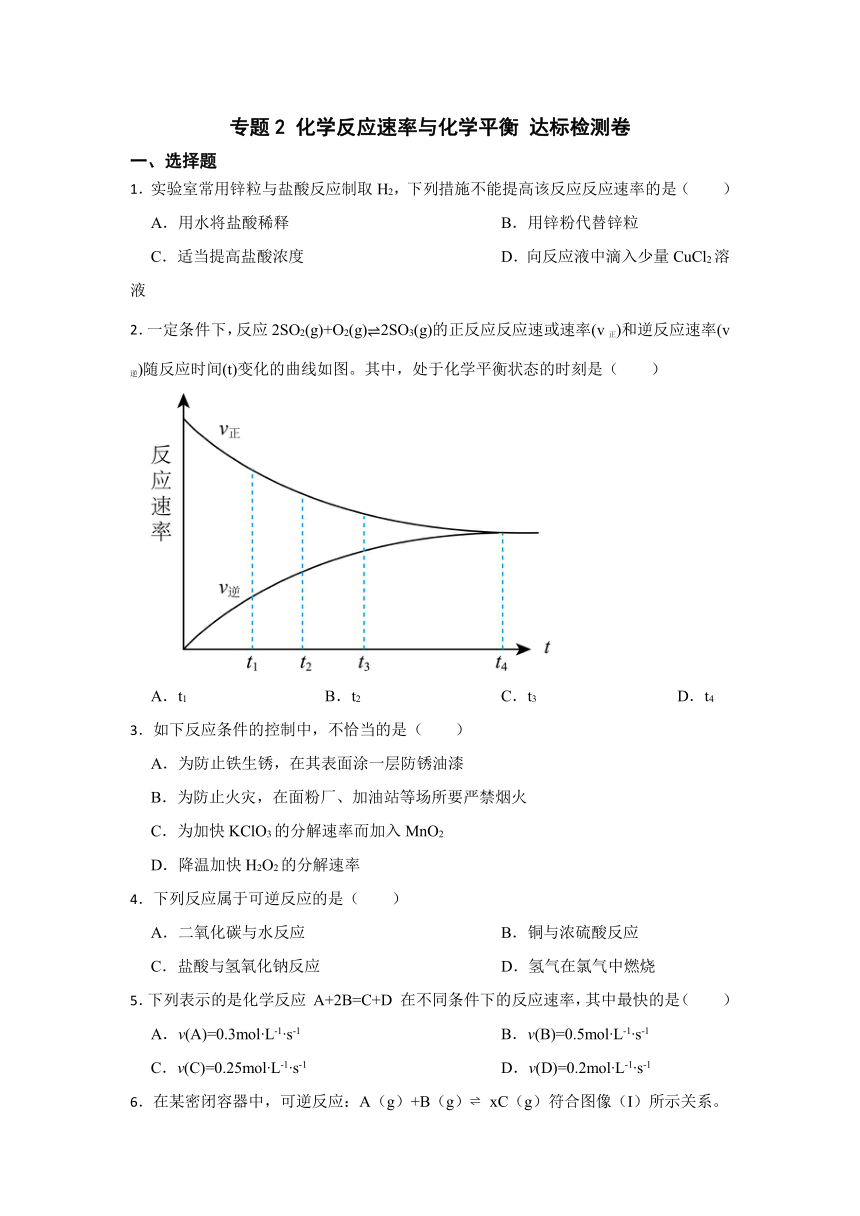
2.一定条件下,反应2SO2(g)+O2(g)2SO3(g)的正反应反应速或速率(v正)和逆反应速率(v逆)随反应时间(t)变化的曲线如图。其中,处于化学平衡状态的时刻是( )
A.t1 B.t2 C.t3 D.t4
3.如下反应条件的控制中,不恰当的是( )
A.为防止铁生锈,在其表面涂一层防锈油漆
B.为防止火灾,在面粉厂、加油站等场所要严禁烟火
C.为加快KClO3的分解速率而加入MnO2
D.降温加快H2O2的分解速率
4.下列反应属于可逆反应的是( )
A.二氧化碳与水反应 B.铜与浓硫酸反应
C.盐酸与氢氧化钠反应 D.氢气在氯气中燃烧
5.下列表示的是化学反应 A+2B=C+D 在不同条件下的反应速率,其中最快的是( )
A.v(A)=0.3mol L-1 s-1 B.v(B)=0.5mol L-1 s-1
C.v(C)=0.25mol L-1 s-1 D.v(D)=0.2mol L-1 s-1
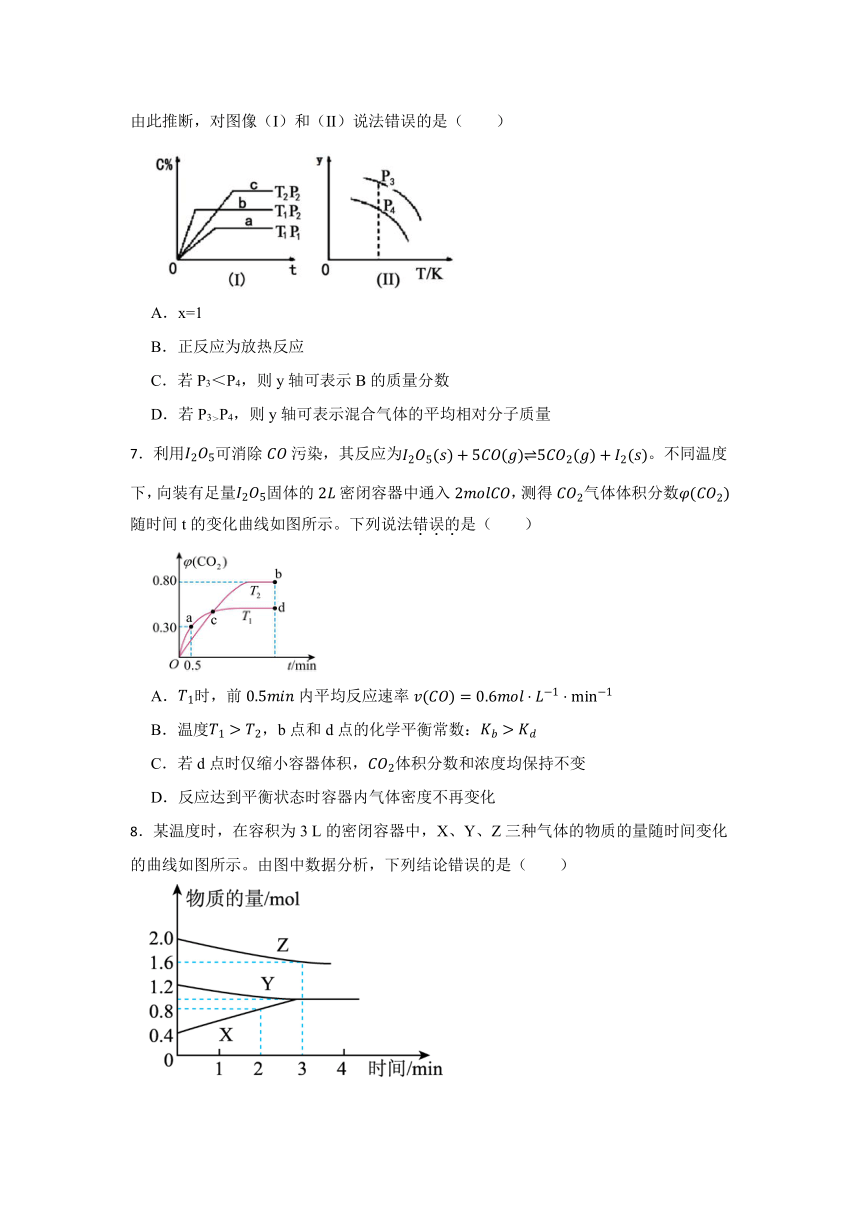
6.在某密闭容器中,可逆反应:A(g)+B(g) xC(g)符合图像(I)所示关系。由此推断,对图像(I)和(II)说法错误的是( )
A.x=1
B.正反应为放热反应
C.若P3<P4,则y轴可表示B的质量分数
D.若P3>P4,则y轴可表示混合气体的平均相对分子质量
7.利用可消除污染,其反应为。不同温度下,向装有足量固体的密闭容器中通入,测得气体体积分数随时间t的变化曲线如图所示。下列说法错误的是( )
A.时,前内平均反应速率
B.温度,b点和d点的化学平衡常数:
C.若d点时仅缩小容器体积,体积分数和浓度均保持不变
D.反应达到平衡状态时容器内气体密度不再变化
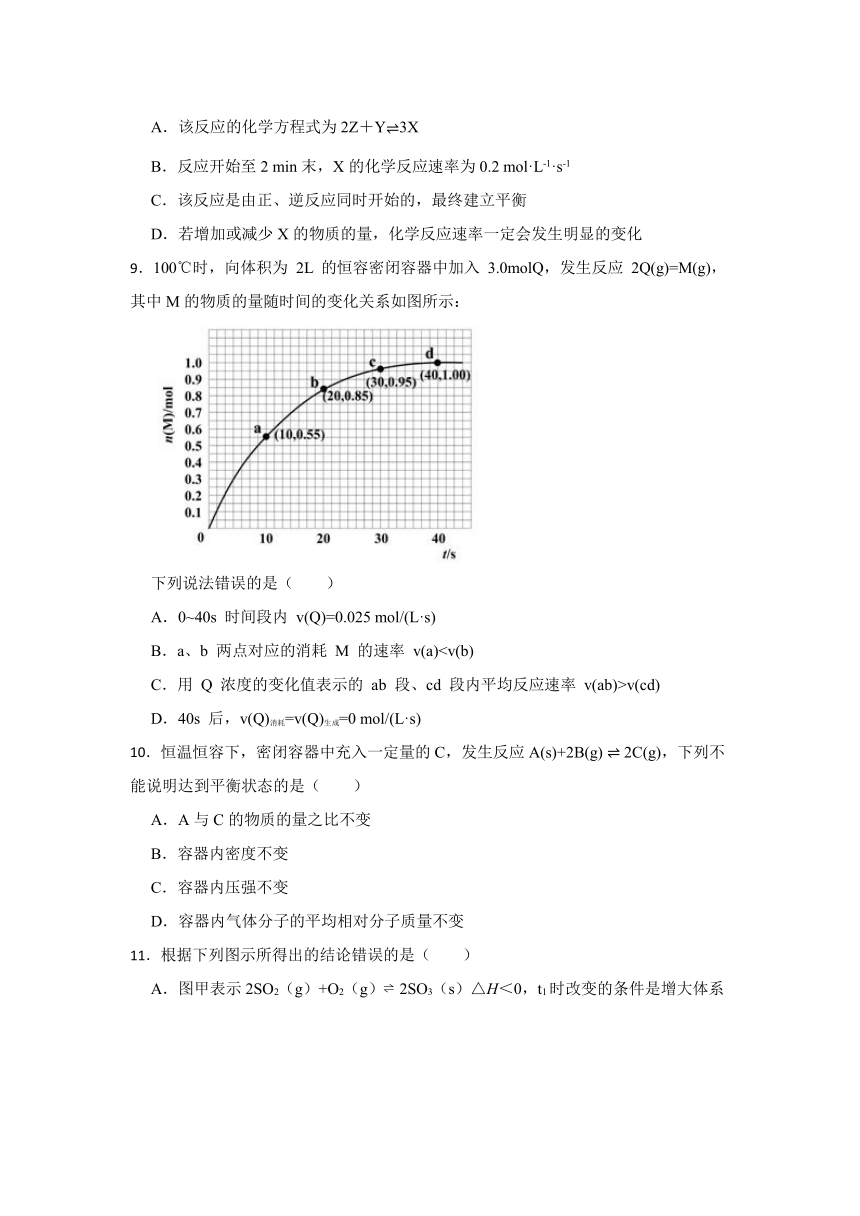
8.某温度时,在容积为3 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。由图中数据分析,下列结论错误的是( )
A.该反应的化学方程式为2Z+Y3X
B.反应开始至2 min末,X的化学反应速率为0.2 mol·L-1·s-1
C.该反应是由正、逆反应同时开始的,最终建立平衡
D.若增加或减少X的物质的量,化学反应速率一定会发生明显的变化
9.100℃时,向体积为 2L 的恒容密闭容器中加入 3.0molQ,发生反应 2Q(g)=M(g),其中M的物质的量随时间的变化关系如图所示:
下列说法错误的是( )
A.0~40s 时间段内 v(Q)=0.025 mol/(L·s)
B.a、b 两点对应的消耗 M 的速率 v(a)
C.用 Q 浓度的变化值表示的 ab 段、cd 段内平均反应速率 v(ab)>v(cd)
D.40s 后,v(Q)消耗=v(Q)生成=0 mol/(L·s)
10.恒温恒容下,密闭容器中充入一定量的C,发生反应A(s)+2B(g) 2C(g),下列不能说明达到平衡状态的是( )
A.A与C的物质的量之比不变
B.容器内密度不变
C.容器内压强不变
D.容器内气体分子的平均相对分子质量不变
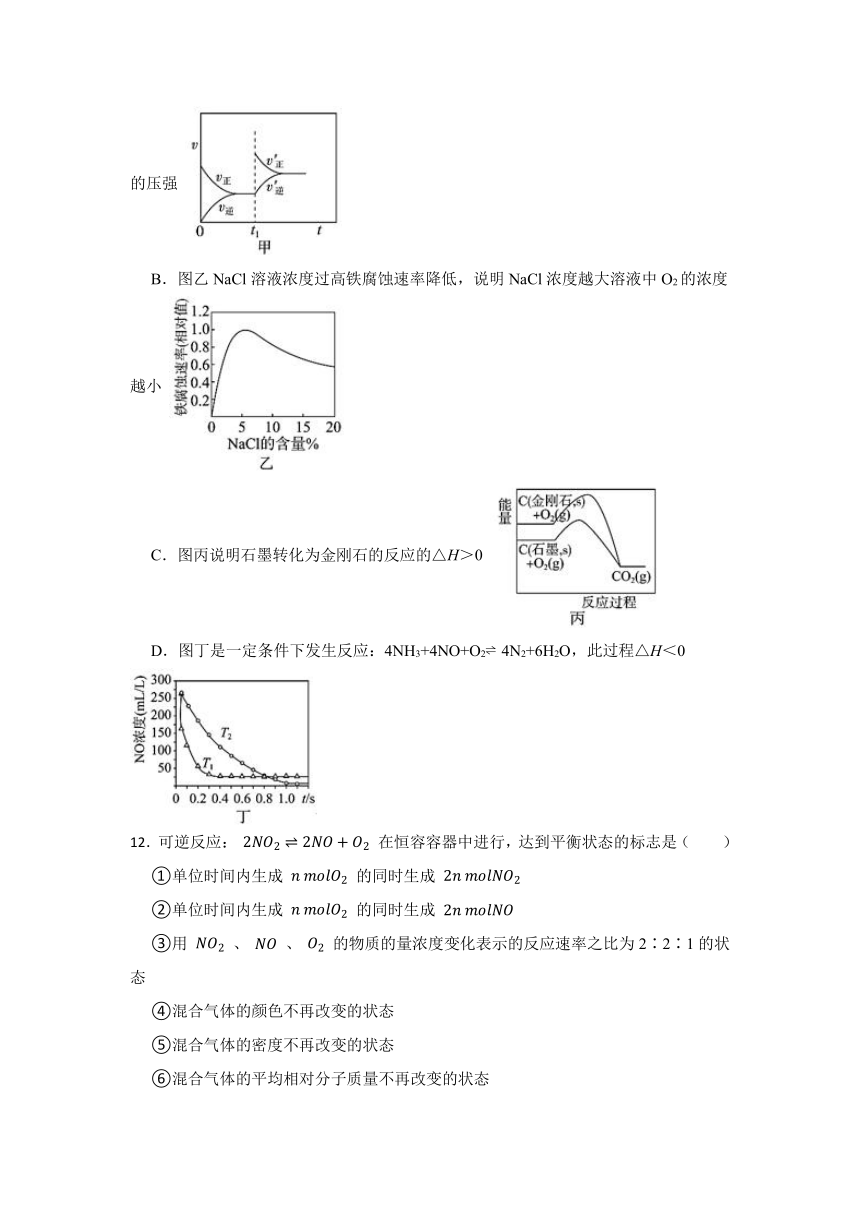
11.根据下列图示所得出的结论错误的是( )
A.图甲表示2SO2(g)+O2(g) 2SO3(s)△H<0,t1时改变的条件是增大体系的压强
B.图乙NaCl溶液浓度过高铁腐蚀速率降低,说明NaCl浓度越大溶液中O2的浓度越小
C.图丙说明石墨转化为金刚石的反应的△H>0
D.图丁是一定条件下发生反应:4NH3+4NO+O2 4N2+6H2O,此过程△H<0
12.可逆反应: 在恒容容器中进行,达到平衡状态的标志是( )
①单位时间内生成 的同时生成
②单位时间内生成 的同时生成
③用 、 、 的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤
C.①③④ D.①②③④⑤⑥
二、非选择题
13.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
实验 序号 实验温度/K 参加反应的物质 溶液颜色褪至无色时所需时间/s
KMnO4溶液(含硫酸) H2C2O4溶液 H2O
V/mL c/mol·L-1 V/mL c/mol·L-1 V/mL
A 293 2 0.02 4 0.1 0 6
B T1 2 0.02 3 0.1 V1 8
C 313 2 0.02 V2 0.1 1 t1
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1= ,T1= ;通过实验 可探究出温度变化对化学反应速率的影响。
(2)C组实验中溶液褪色时间t1 (填“>”或“<”)8s,C组实验的反应速率v(KMnO4) = 。(用含有t1的式子表示)
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并以此分析造成n(Mn2+)突变的可能的原因是: 。
14.亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。已知:HNO2既有氧化性又有还原性;AgNO2微溶于水,能溶于硝酸:AgNO2+HNO3= AgNO3+ HNO2。
(1)利用Ⅰ、Ⅱ、Ⅲ装置制备原料气NO和Cl2
① 写出利用装置Ⅰ制备氯气的离子反应方程式: 。
② 利用上述装置制备NO时,Ⅱ中盛装物质为 (写化学式)。
(2)利用以下装置在常温常压下制备ClNO
① 装置连接顺序为a→ (按气流自左向右方向,用小写字母表示)。
② 为使NO和Cl2恰好完全反应生成ClNO,理论上通入NO和Cl2两种气体的流速比为 。
③ 装置Ⅸ的作用是 。
④ 装置Ⅷ吸收尾气时,有同学认为尾气中的某种气体不能完全被吸收,为了充分吸收尾气,可将尾气与 (气体)同时通入NaOH溶液中。
⑤ 王水是浓盐酸和浓硝酸的混酸,一定条件下混酸可生成ClNO和Cl2,该反应的化学方程式为 。
⑥ 写出验证ClNO与H2O完全反应后的溶液中存在Cl-和HNO2的实验步骤:取少量反应后的溶液于试管中, 。(限选试剂如下:AgNO3溶液,稀硝酸,KMnO4溶液)
三、综合题
15.二氧化碳的捕集与资源化利用是实现碳减排的重要途径。
(1) 的电子式是 。
(2)下列物质理论上可以作为 捕集吸收剂的是 。(填序号)
a.稀 b.氨水c. 溶液d. 溶液
(3)工业上以 、 为原料生产尿素 ,该反应分为二步进行:
第一步:
第二步:
①写出上述合成尿素的热化学方程式 。
②某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入 和 ,实验测得反应中各组分物质的量随时间的变化如图所示:
已知总反应的快慢由慢的一步反应决定,则合成尿素总反应的快慢由第 步反应决定,总反应进行到 min时到达平衡。
(4) 较稳定、能量低。为实现 的资源化利用,下列研究方向合理的是 (填序号)。
a.选择低能量的反应物和 反应获得高能量的生成物
b.利用电能、光能或热能活化 分子
c.选择高效的催化剂
16.
(1)I.联氨(N2H4)是火箭燃料,有专家设计了一种联氨环保电池,其工作原理如图所示。回答下列问题:
联氨的电子式为 。
(2)c口通入 ,N极为电源的 极,N极反应式 。
(3)M极反应式为 ,电极附近碱性 (填增强、减弱或不变)。
(4)Ⅱ.化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是____。
A.将肉类等食品进行低温冷藏,能使其永远不会腐败变质
B.在化学工业中,催化剂不参与反应,但能增大反应速率
C.自然条件下,夏天面粉发酵速度与冬天面粉发酵速度相差不大
D.茶叶等包装中加入的还原性铁粉能延长茶叶储存时间
(5)用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是____。
A.对该反应体系加热
B.向溶液中滴加浓硝酸,以增大氢离子浓度
C.滴加少量CuSO4溶液
D.改用铁粉
E.改用浓度为98.3%的浓硫酸
(6)反应4A(s)+3B(g)=2C(g)+D(g),经2min,B的浓度减少0.6mol·L-1。对此反应速率的表示正确的是____。
A.用A表示的反应速率是0.4mol·(L·min)-1
B.分别用B、
C.D表示反应的速率,其比是3:2:1C.在2min末的反应速率,用B表示是0.3mol·(L·min)-1
D.在这2min内用B和C表示的反应速率的值都是逐渐减小的
(7)Ⅲ.化学反应伴随着能量变化是化学反应的基本特征之一
下列物质发生的变化中属于吸热反应的是 。
①氢氧化钡与氯化铵混合后搅拌 ②盐酸滴入碳酸氢钠
③炽热的碳与二氧化碳 ④硝酸铵固体投入水中
(8)某同学进行如下实验,以检验化学反应中的能量变化。回答问题:
实验中发现,反应后温度计示数升高。由此判断铝条与盐酸的反应是 (填“吸”或“放”)热反应。其能量变化 (填“能”或“不能”)用如图表示。
答案解析部分
1.【答案】A
【解析】【解答】A.用水将盐酸稀释,氢离子浓度减小,反应速率降低,A符合题意;
B.将锌粒改为锌粉,固体表面积增大,反应速率增大,B不符合题意;
C.适当提高盐酸浓度,氢离子浓度增大,反应速率增大,C不符合题意;
D.锌置换出铜,形成铜锌原电池反应,反应速率增大,D不符合题意;
故答案为:C。
【分析】A.溶液浓度越小,反应速率越慢
B.固体粉状比块状的反应速率快
C.酸的浓度适当提高,反应速率增大
D.原电池可以加快反应速率
2.【答案】D
【解析】【解答】t4时刻时,正逆反应速率相等,反应达到平衡状态。
故答案为:D
【分析】当正逆反应速率相等时,反应达到平衡状态。
3.【答案】D
【解析】【解答】A.防止铁生锈,在其表面涂一层防锈油漆,阻止铁与潮湿的空气接触,故A恰当;
B.面粉厂、纺纱厂、加油站周围的空气中漂浮着可燃性的气体或粉尘,遇明火可能会发生爆炸,所以面粉厂、纺纱厂、加油站均要严禁烟火,故B恰当;
C.加入MnO2,对KClO3的分解起催化作用,催化剂可加快化学反应速率,故C恰当;
D.温度越低反应速率越慢,降温会减慢H2O2的分解速率,故D不恰当;
故答案为:D。
【分析】D、降温反应速率减慢
4.【答案】A
【解析】【解答】A.二氧化碳和水反应生成碳酸,碳酸不稳定,同时又可以分解为二氧化碳和水,故是可逆反应,故A选;
B.铜和浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,硫酸铜、二氧化硫和水不能反应生成铜和硫酸,反应不可逆,故B不选;
C.盐酸与氢氧化钠发生酸碱中和反应,生成的NaCl和水不能反应生成盐酸和氢氧化钠,反应不可逆,故C不选;
D.氢气在氯气中燃烧生成氯化氢,氯化氢很稳定,不会在点燃条件下分解为氢气和氯气,故D不选;
故答案为:A。
【分析】可逆反应是在相同条件下,既可以向正反应方向进行,同时又能向逆反应方向进行的反应。
5.【答案】A
【解析】【解答】在相同情况下,在同一化学反应中,用不同的物质表示化学反应速率,其数值之比等于化学计量数之比,即有v(A)= =v(C)=v(D)。可以把不同情况下的反应速率统一用A表示。
A.v(A)=0.3mol L-1 s-1;
B.v(A)= =0.25mol L-1 s-1;
C.v(A)=v(C)=0.25mol L-1 s-1;
D.v(A)=v(D)=0.2mol L-1 s-1。
综上化学反应速率最快的是A项中的速率;
故答案为:A。
【分析】在同一化学反应中,反应速率之比等于化学计量系数之比。像题干中,当给出不同物质的速率,让比较大小时,需要换算成同一个物质的速率作比较。题干中因为A :B:C:D=1:2:1:1,所以v(A)= =v(C)=v(D);换算完以后,A项数值最大,所以A是正确选项
6.【答案】C
【解析】【解答】A.据图像(Ⅰ)知,曲线b比a先达到平衡,故压强p2>P1,增大压强(p1→p2)时,C%增大,即平衡正向移动,故x<2即x=1,故A不符合题意;
B.曲线b比c先达到平衡,故T1>T2;降温(T1→T2)时,C%增大,即平衡正向移动,说明正反应为放热反应,故B不符合题意;
C.相同温度下增大压强平衡正向移动,B的转化率增大,所以若P3>P4,y轴不能表示B的质量分数,故C符合题意;
D.相同温度下增大压强平衡正向移动,气体的物质的量减少,但总质量不变,所以平均相对分子质量变大,所以若P3>P4,y轴可以表示混合气体的平均相对分子质量,故D不符合题意;
故答案为:C。
【分析】A.增大压强,平衡向气体分子数减小的方向移动;
B.依据先拐先平数值大;
C.增大压强,平衡向气体分子数减小的方向移动;
D.增大压强,平衡向气体分子数减小的方向移动;
7.【答案】C
【解析】【解答】A. 时,前内平均反应速率,故A不符合题意;
B. 图象分析可知,先拐先平,温度高,得到T2<T1 ,温度高,平衡常数小,b点和d点的化学平衡常数:,故B不符合题意;
C. 若d点时仅缩小容器体积,体积分数保持不变,但浓度增大,故C符合题意;
D. 反应达到平衡状态时,气体的总质量、容器的体积保持不变,容器内气体密度不再变化,故D不符合题意;
故答案为:C。
【分析】A.依据计算;同一反应不同物质相同时段内,用相同单位表示反应速率时,速率之比等于计量数之比。
B. 依据图像,先拐先平,温度高;
C.根据影响化学平衡移动的因素分析;
D. 利用“变者不变即平衡”;
8.【答案】B
【解析】【解答】A.由图象可以看出,反应中Z、Y的物质的量减少,应为反应物,X的物质的量增多,应为生成物,当反应进行到3min时, n(Y)=0.2mol, n(Z)=0.4mol, n(X)=0.6mol,则 n(Y): n(Z): n(X)=1:2:3,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为:2Z+Y3X,A不符合题意;
B.反应开始至2 min末, n(X)=0.8mol-0.4mol=0.4mol,容器体积为3L,所以X的化学反应速率为=mol/(L·min)=4mol/(L·s),B符合题意;
C.X、Y、Z起始量不为0,该反应是由正、逆反应同时开始的,最终建立平衡,C不符合题意;
D.若增加或减少X的物质的量,生成物的浓度发生变化,逆反应速率会发生改变,从而也会正反应速率,D不符合题意;
故答案为:B。
【分析】A.合图像中X,Y,Z物质的量变化量与系数成正比,但是同时要注意该反应为可逆反应
B.结合图像,算出X的浓度变化量,算出X的速率
C.与图可知,一开始X,Y,Z都存在,说明正逆反应同时建立的
D.X浓度发生变化,化学反应速率也会改变
9.【答案】D
【解析】【解答】A.开始时Q的浓度为1.5mol/L,反应达40s时,M的浓度为0.5mol/L,由化学方程式可知2Q(g)=M(g),则从反应开始到刚达到平衡时间段内v(Q)= mol/(L·s)=0.025 mol/(L·s),故A项不符合题意;
B.M为生成物,消耗M的反应速率表示逆反应的速率,逆反应速率从开始至平衡逐渐大,故则a、b两时刻消耗M的速率v(a)<v(b),故B项不符合题意;
C.ab段M的浓度变化量为(0.85-0.55)mol/2L=0.15 mol/L,ab段Q的浓度变化量为0.15mol/L×2=0.3mol/L,v(ab)= =0.03 mol/(L·s),cd段M的浓度变化量为(1-0.95)mol/2L=0.025 mol/L,cd段Q的浓度变化量为0.025mo/L×2=0.05mol/L,v(cd)= =0.005mol/(L·s),所以v(ab)>v(cd),故C项不符合题意;
D.40s 后,反应达到平衡状态,v(Q)消耗=v(Q)生成 0 mol/(L·s),故D项符合题意;
故答案为:D。
【分析】A.根据v=△c/△t计算0~40s时间段内v(M),结合方程式计算v(Q);
B.随着反应的进行,消耗的W的浓度越来越小,生成W的速率即逆反应速率越来越大;
C.随着反应的进行,Q的浓度越来越小,反应速率越来越小;
D.反应达到平衡时,同一物质的正反应速率等于其逆反应速率。
10.【答案】C
【解析】【解答】A.反应从逆向建立平衡,随着反应进行,C物质的量逐渐变少,A物质的量逐渐变多,两者比值时刻在变,达到平衡时,A、C量保持不变,比值也不变,故A能判断平衡状态,不符合题意;
B.依据 ,随着反应进行,mg(总)要发生改变,故ρ也改变,当其不变时即达平衡,B不符合题意;
C.反应前后气体的物质的量不变,体积也不变,故P一直不变,不能用来判断平衡状态,C符合题意;
D.依据 ,随着反应进行,mg(总)要发生改变,故气体平均分子质量( )也改变,当其不变时即达平衡,D不符合题意;
故答案为:C。
【分析】根据反应 A(s)+2B(g) 2C(g) ,气体的系数不变,在恒温恒容下,增加C的量,发生反应,可以根据A和C的物质的量之比以及密度以及平均相对分子质量不变即可判断
11.【答案】A
【解析】【解答】A. 根据图象,t1时刻v逆瞬间不变,v正瞬间增大,则是增大反应物浓度,故A符合题意;
B. O2的含量影响碳钢在NaCl溶液中的腐蚀速率,根据图象,腐蚀速率先增大,增大到最大后减小,说明在NaCl浓度较高时溶液中O2的浓度减少,正极反应减慢导致腐蚀速率降低,故B不符合题意;
C. 石墨能量低于金刚石能量,所以石墨转化为金刚石的反应的△H>0,故C不符合题意;
D. 图丁是一定条件下发生反应:4NH3+4NO+O2 4N2+6H2O,根据图像,以先拐先平数值大为原则,则T1>T2,升高温度,NO的体积浓度增大,平衡逆向移动,则正反应为放热反应,△H<0,故D不符合题意;
故答案为:A。
【分析】A.根据图示,增大压强应该都增大,不会出现v逆瞬间不变,因此是表示的增加反应物的浓度
B.根据即可得出,氯化钠溶液的浓度对钢铁的腐蚀其到促进作用
C.焓变=生成物的能量-反应物的能量即可判断
D.根据达到平衡的时间长短即可判断温度大小,温度越高,时间越短
12.【答案】A
【解析】【解答】①单位时间内生成 的同时生成 ,说明反应v(正)=v(逆),达到平衡状态,①符合题意;②单位时间内生成 的同时生成 ,这是必然的,无论反应是否达到平衡状态都满足, ,不能说明达到平衡状态,②不符合题意;③反应中必然满足 和 ,但是只有 才平衡,当用 、 、 的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态,可能已经平衡,也可能没有平衡,与各物质的初始浓度及转化率有关,③不符合题意; ④混合气体的颜色不再改变,说明NO2气体的浓度不变,达到平衡状态,④符合题意;⑤无论反应是否达到平衡状态,混合气体的质量不变,容器的体积不变,所以混合气体的密度不变,不能说明达到平衡状态,⑤不符合题意; ⑥反应前后气体的化学计量数之和不相等,反应过程中,混合气体的物质的量一直变化,又因为气体质量不变,所以混合气体的平均相对分子质量一直不变,当其不再变化时,说明达到平衡状态,⑥符合题意;
故答案为:A。
【分析】化学平衡状态标志有:正逆反应速率相等;各物质的浓度、百分含量不变;以及由此衍生的一些量也不发生变化能折合成以上特征的,可以选择一个物理量,会随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态,例如本题中混合气体的平均相对分子质量,会随着反应而变化,后来不变了,就达平衡了。
13.【答案】(1)1;293;B、C
(2)<;0.02/3t1mol·L-1·s-1
(3)生成的Mn2+对反应有催化作用,使得反应速率加快,单位时间内产生的n(Mn2+)突增
【解析】【解答】(1)通过A、B实验探究浓度对反应速率的影响,应控制浓度不同,温度和溶液的体积都相同,因此其中V1=1,T1=293;
欲探究温度对反应速率的影响,应控制温度不同,因此应选用实验B和C;
(2)C组实验的温度高于B组实验的温度,而温度越高,反应速率越快,故C组实验中溶液褪色的时间小于8s;
C组实验中用KMnO4溶液表示反应速率为;
(3)生成的Mn2+对反应有催化作用,使得反应速率加快,单位时间内产生的n(Mn2+)突增;
【分析】(1)探究浓度对反应速率的影响,应控制浓度不同,其他条件相同;
探究温度对反应速率的影响,应控制温度不同,其他条件相同;
(2)C组实验温度较高,结合温度对反应速率的影响分析褪色时间;
根据公式计算反应速率;
(3)结合Mn2+的催化作用分析;
14.【答案】(1)MnO2+4H++2Cl- Mn2+ + Cl2↑+2H2O;H2O
(2)a→e→f→c→b→d (或a→f→e→c→b→d);2∶1;冷凝亚硝酰氯,便于收集;O2(或空气);HNO3(浓)+3HCl(浓)=ClNO↑+Cl2↑+2H2O;依次滴加足量的AgNO3溶液和稀硝酸,充分振荡、静置,有白色沉淀生成;另取静置后上层清液少许于另一支试管中,滴加KMnO4溶液,溶液紫色褪去
【解析】【解答】(1)、①制备氯气的离子反应方程式:MnO2+4H++2Cl- Mn2+ + Cl2↑+2H2O;
②实验室收集NO只能用排水法,选择试剂H2O;(2)、①ClNO易与水反应,装置VII可以防止尾气吸收装置VIII的水蒸气进入,所以连接顺序为a→e→f→c→b→d;
②由反应2NO+Cl2=2ClNO可知理论上通入NO和Cl2两种气体的流速比为2:1时恰好完全反应生成ClNO;
③ 由于ClNO沸点:-6.4℃,所以需要冰盐(-10℃)冷凝亚硝酰氯,才便于收集;
④空气中氧气与NO反应生成NO2,同时通入NaOH溶液中被NaOH溶液吸收,避免NO逸出污染空气;
⑤王水是浓盐酸和浓硝酸的混酸,一定条件下混酸可生成ClNO和Cl2,根据得失电子守恒和原子守恒,该反应的化学方程式为:HNO3(浓)+3HCl(浓)=ClNO↑+Cl2↑+2H2O;
⑥验证ClNO与H2O完全反应后的溶液中存在Cl-和HNO2,可根据Cl-与Ag+反应生成白色沉淀及HNO2具有还原性进行判断,具体操作为:依次滴加足量的AgNO3溶液和稀硝酸,充分振荡、静置,有白色沉淀生成;另取静置后上层清液少许于另一支试管中,滴加KMnO4溶液,溶液紫色褪去。
【分析】(1)书写离子方程式时注意标注反应条件,同时遵循电荷守恒、原子守恒;实验室收集NO只能用排水法,据此分析;
(2) ① 根据ClNO的性质,结合尾气处理分析解答;
② 化学方程式的系数之比等于两种气体的流速比;
③ 根据ClNO的性质分析;
④ 空气中氧气与NO反应生成NO2,据此解答即可;
⑤ 根据得失电子守恒和原子守恒书写方程式,并注意标注对应的气体符号;
⑥ 可根据Cl-与Ag+反应生成白色沉淀及HNO2具有还原性进行判断,据此解答。
15.【答案】(1)
(2)b、c
(3);第二步;55
(4)b、c
【解析】【解答】(1) 的电子式是 ;
(2)氯化铵和硫酸均不与二氧化碳发硬,碳酸铵、氨水可吸收二氧化碳,
故答案为:bc;
(3)①根据盖斯定律,将第一步和第二步方程式相加可得, ;
②根据图示分析,氨气、二氧化碳合成 反应较快, 合成 反应较慢,则合成尿素总反应的快慢由第二步反应决定;总反应进行到55min,反应达到平衡;
(4)题干说明了二氧化碳较稳定,能量低,a为选择低能量的反应物和 反应获得高能量的生成物,低能量的反应物和低能量的二氧化碳反应无法获得高能量的生成物,这个方向是不合理的,不正确;
b电能、光能或热能活化的 分子得到的能量较高是可以作为研究方向的,正确;
c选择高效的催化剂,能够加大二氧化碳的利用率,能达到二氧化碳的利用研究,正确;
【分析】(1)根据二氧化碳的结构式即可写出电子式
(2)与二氧化碳反应的物质均可以作为二氧化碳的吸收剂,找出即可
(3)① 利用盖斯定律即可写出热化学方程式②根据图示即可找出步骤II反应慢,根据图示即可找出达到平衡的时间
(4) 较稳定、能量低。为实现 的资源化利用, 可以利用电能、光能或者热能激发活化二氧化碳分子加速二氧化碳的利用,可以选择高效的催化剂提高二氧化碳的利用率
16.【答案】(1)
(2)O2;正;O2+4e-+4H+=2H2O
(3)N2H4-4e-=N2↑+4H+;减弱
(4)D
(5)B;E
(6)B
(7)①②③
(8)放;能
【解析】【解答】I.(1)联氨的分子式为N2H4,电子式为。
(2)氢离子向右侧移动,电极N是正极,则c口通入O2,N极反应式为O2+4e-+4H+=2H2O。
(3)M极是负极,反应式为N2H4-4e-=N2↑+4H+,由于有氢离子生成,则电极附近碱性减弱。
Ⅱ.(4)A.将肉类等食品进行低温冷藏,能减缓腐蚀的速率,但不能使其永远不会腐败变质,A不正确;
B.在化学工业中,催化剂参与反应,B不正确;
C.自然条件下,由于夏天温度高,所以夏天面粉发酵速度与冬天面粉发酵速度相差较大,C不正确;
D.还原性铁粉具有还原性,是抗氧化剂,所以茶叶等包装中加入的还原性铁粉能延长茶叶储存时间,D正确;
故答案为:D。
(5)A.对该反应体系加热,即升高温度反应速率加快,A不符合;
B.向溶液中滴加浓硝酸,硝酸是氧化性酸,和金属反应不能生成氢气,B符合;
C.滴加少量CuSO4溶液,铁置换出铜,构成原电池,反应速率加快,C不符合;
D.改用铁粉,增大反应物的接触面积,反应速率加快,D不符合;
E.改用浓度为98.3%的浓硫酸,常温下铁在浓硫酸中钝化,得不到氢气,E符合;
故答案为:BE。
(6)A.A是固体,不能用A表示反应速率,A不正确;
B.反应速率之比是化学计量数之比,则分别用B、C、D表示反应的速率,其比是3:2:1,B正确;
C.应该是在2min内用B表示是的平均反应速率是0.3mol·(L·min)-1,C不正确;
D.C是生成物,在这2min内用C表示的反应速率的值是逐渐增大的,D不正确;
故答案为:B。
Ⅲ.(7)①氢氧化钡与氯化铵混合后搅拌属于吸热反应;②盐酸滴入碳酸氢钠中发生的是吸热反应;③炽热的碳与二氧化碳反应生成CO,属于吸热反应;④硝酸铵固体投入水中属于物理变化,不是吸热反应;
故答案为:①②③;
(8)实验中发现,反应后温度计示数升高,由此判断铝条与盐酸的反应是放热反应。反应放热说明反应物总能量高于生成物总能量,因此其能量变化能用如图表示。
【分析】Ⅰ.燃料电池中,通入燃料的一极为负极,负极发生氧化反应,通入氧气的一极为正极,正极发生还原反应,原电池中阳离子向正极移动,则电极N为正极,电极M为负极;
Ⅱ.化学反应速率的影响因素主要有温度、浓度、催化剂等;同一个化学反应,用不同的物质表示反应速率时,速率数值可能不同,但表示的意义是相同的,所以比较反应速率快慢时,应该根据速率之比等于相应的化学计量数之比,速率与计量系数的比值越大,反应速率越快;
Ⅲ.常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应、绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱);盐酸和碳酸氢钠的反应;
铝和盐酸的反应是放热反应,放热反应反应物的总能量大于生成物的总能量
图片资源预览